SAMENVATTING VAN DE PRODUCTKENMERKEN
![]() Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
1. NAAM VAN HET GENEESMIDDEL
Columvi 2,5 mg concentraat voor oplossing voor infusie
Columvi 10 mg concentraat voor oplossing voor infusie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Columvi 2,5 mg concentraat voor oplossing voor infusie
Elke injectieflacon van 2,5 ml concentraat bevat 2,5 mg glofitamab in een concentratie van 1 mg/ml.
Columvi 10 mg concentraat voor oplossing voor infusie
Elke injectieflacon van 10 ml concentraat bevat 10 mg glofitamab in een concentratie van 1 mg/ml.
Glofitamab is een gehumaniseerd anti-CD20/anti-CD3 bispecifiek monoklonaal antilichaam geproduceerd in ovariumcellen van de Chinese hamster (CHO-cellen) door middel van recombinant-DNA-technologie.
Hulpstoffen met bekend effect
Elke injectieflacon met Columvi van 2,5 ml bevat 1,25 mg (0,5 mg/ml) polysorbaat 20.
Elke injectieflacon met Columvi van 10 ml bevat 5 mg (0,5 mg/ml) polysorbaat 20.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Concentraat voor oplossing voor infusie (steriel concentraat).
Kleurloze, heldere oplossing met een pH van 5,5 en osmolaliteit van 270 ‑ 350 mOsm/kg.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
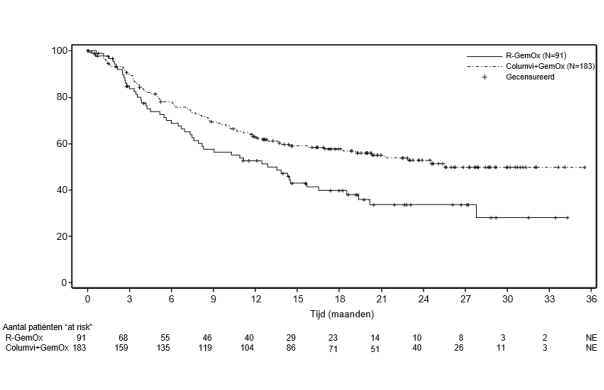
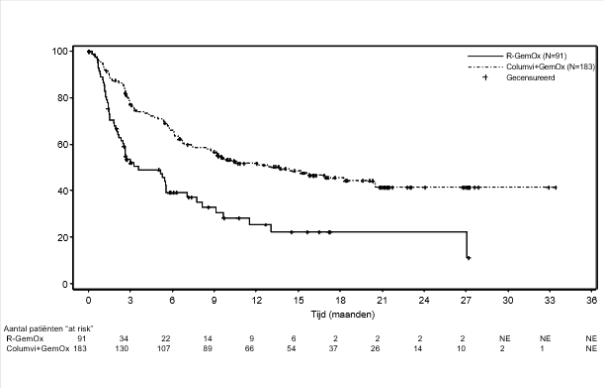
Columvi in combinatie met gemcitabine en oxaliplatine is geïndiceerd voor de behandeling van volwassen patiënten met recidiverend of refractair diffuus grootcellig B-cellymfoom niet anders gespecificeerd (DLBCL NOS) die niet in aanmerking komen voor autologe stamceltransplantatie (ASCT).
Columvi is als monotherapie geïndiceerd voor de behandeling van volwassen patiënten met recidiverend of refractair diffuus grootcellig B-cellymfoom (DLBCL) die ten minste twee eerdere systemische behandelingen hebben gekregen.
4.2 Dosering en wijze van toediening
Columvi mag alleen worden toegediend onder toezicht van een beroepsbeoefenaar in de gezondheidszorg die ervaren is in het diagnosticeren en behandelen van patiënten met kanker, in een omgeving met passende medische ondersteuning om ernstige reacties geassocieerd met ‘cytokine release’-syndroom (CRS) en immuun-effectorcel-geassocieerd neurotoxiciteitssyndroom (ICANS) te behandelen.
Voorafgaand aan de Columvi-infusie bij cyclus 1 en 2 moet ten minste 1 dosis tocilizumab voor gebruik bij CRS beschikbaar zijn. De beschikbaarheid van een extra dosis tocilizumab binnen 8 uur na het gebruik van de vorige dosis tocilizumab moet worden gewaarborgd (zie rubriek 4.4).
Voorbehandeling met obinutuzumab
Alle patiënten in onderzoek NP30179 en in onderzoek GO41944 (STARGLO) ontvingen een enkelvoudige dosis van 1.000 mg obinutuzumab als voorbehandeling op dag 1 van cyclus 1 (7 dagen vóór de start van de behandeling met Columvi) om het aantal circulerende en lymfoïde B-cellen te verlagen (zie tabel 2, uitgestelde of gemiste doses, en rubriek 5.1).
Obinutuzumab werd toegediend als een intraveneuze infusie van 50 mg/uur. De infusiesnelheid werd elke 30 minuten verhoogd in stappen van 50 mg/uur tot een maximum van 400 mg/uur.
Raadpleeg de Samenvatting van Productkenmerken van obinutuzumab voor volledige informatie over premedicatie, bereiding, toediening en behandeling van bijwerkingen van obinutuzumab.
Premedicatie en profylaxe
Profylaxe ‘cytokine release’-syndroom
Columvi moet worden toegediend aan goed gehydrateerde patiënten. Aanbevolen premedicatie voor CRS (zie rubriek 4.4) staat vermeld in tabel 1.
Tabel 1. Premedicatie voorafgaand aan Columvi-infusie
Behandelingscyclus (dag) | Patiënten die premedicatie nodig hebben | Premedicatie | Toediening |
Cyclus 1 (dag 8, dag 15); | Alle patiënten | 20 mg intraveneus dexamethason1 | Afgerond ten minste 1 uur vóór infusie van Columvi |
Oraal analgeticum / antipyreticum2 | Ten minste 30 minuten vóór infusie van Columvi | ||
Antihistaminicum3 | |||
Alle daaropvolgende infusies | Alle patiënten | Oraal analgeticum / antipyreticum2 | Ten minste 30 minuten vóór infusie van Columvi |
Antihistaminicum3 | |||
Patiënten die CRS kregen bij de eerdere dosis | 20 mg intraveneus dexamethason1, 4 | Afgerond ten minste 1 uur vóór infusie van Columvi |
1 Als de patiënt dexamethason niet verdraagt of als dexamethason niet verkrijgbaar is, moet 100 mg prednison/prednisolon of 80 mg methylprednisolon worden toegediend.
2 Bijvoorbeeld 1.000 mg paracetamol.
3 Bijvoorbeeld 50 mg difenhydramine.
4 Moet worden toegediend als aanvulling op de premedicatie die voor alle patiënten vereist is.
Infectieprofylaxe
Profylaxe wordt aanbevolen om het risico op infectie te verminderen (zie rubriek 4.4).
Overweeg profylaxe voor cytomegalovirus (CMV), herpes, pneumocystis jiroveci-pneumonie, en andere opportunistische infecties bij patiënten met een verhoogd risico (zie rubriek 4.8).
Dosering
Het toedienen van Columvi begint met een doseringsopbouwschema (dat is ontworpen om het risico op CRS te verminderen), wat leidt tot de aanbevolen dosis van 30 mg.
Doseringsopbouwschema voor Columvi monotherapie
Columvi moet worden toegediend als een intraveneuze infusie volgens het dosis-opbouwschema dat leidt tot de aanbevolen dosis van 30 mg (zoals weergegeven in tabel 2), nadat de voorbehandeling met obinutuzumab op dag 1 van cyclus 1 is voltooid. Elke cyclus duurt 21 dagen.
Tabel 2. Columvi monotherapie doseringsopbouwschema voor patiënten met recidiverend of refractair DLBCL
Behandelingscyclus, dag | Dosis van Columvi | Duur van de infusie | |
Cyclus 1 | Dag 1 | Voorbehandeling met obinutuzumab 1.000 mg1 | |
Dag 8 | 2,5 mg | 4 uur2 | |
Dag 15 | 10 mg | ||
Cyclus 2 | Dag 1 | 30 mg | |
Cyclus 3 tot 12 | Dag 1 | 30 mg | 2 uur3 |
1 Raadpleeg "Voorbehandeling met obinutuzumab" zoals hierboven beschreven. | |||
Doseringsopbouwschema van Columvi in combinatie met gemcitabine en oxaliplatine
Columvi moet worden toegediend als een intraveneuze infusie volgens het doseringsopbouwschema dat leidt tot de aanbevolen dosis van 30 mg (zoals weergegeven in tabel 3), nadat de voorbehandeling met obinutuzumab op dag 1 van cyclus 1 is voltooid.
Columvi wordt gegeven in combinatie met gemcitabine en oxaliplatine in cycli 1-8 en als monotherapie in cycli 9-12. Elke cyclus duurt 21 dagen.
Tabel 3. Doseringsopbouwschema voor Columvi in combinatie met gemcitabine en oxaliplatine bij patiënten met recidiverend of refractair DLBCL
Behandelingscyclus, dag | Dosis van Columvi (duur van de infusie) | Dosis gemcitabine | Dosis oxaliplatine | |
Cyclus 1 | Dag 1 | Voorbehandeling met obinutuzumab 1.000 mga | ||
Dag 2 | – | 1.000 mg/m2 b | 100 mg/m2 b | |
Dag 8 | 2,5 mg (4 uur)c | – | – | |
Dag 15 | 10 mg (4 uur)c | |||
Cyclus 2 | Dag 1 | 30 mg (4 uur)c,d | 1.000 mg/m2 b,d | 100 mg/m2 b,d |
Cyclus 3 tot 8 | Dag 1 | 30 mg (2 uur)d,e | 1.000 mg/m2 b,d | 100 mg/m2 b,d |
Cyclus 9 tot 12 | Dag 1 | 30 mg (2 uur)e | -- | -- |
a Raadpleeg “Voorbehandeling met obinutuzumab” zoals hierboven beschreven.
b Cycli 1-8: Dien gemcitabine toe voorafgaand aan oxaliplatine.
c Bij patiënten die CRS ondervinden bij hun vorige dosis van Columvi, kan de duur van de infusie worden verlengd tot maximaal 8 uur (zie rubriek 4.4).
d Cycli 2-8: Dien Columvi toe voorafgaand aan gemcitabine en oxaliplatine. Gemcitabine en oxaliplatine kunnen worden gegeven op dag 1 of 2.
e Indien de vorige infusie goed werd verdragen, kan de infusietijd naar het oordeel van de behandelend arts worden verkort tot 2 uur. Als de patiënt CRS had bij een vorige dosis, moet de infusieduur van 4 uur worden aangehouden.
Patiënt monitoring
Wanneer Columvi als monotherapie wordt gegeven, moeten de patiënten tijdens elke infusie van Columvi en gedurende ten minste 10 uur nadat de infusie van de eerste dosis Columvi (2,5 mg op dag 8 van cyclus 1) is voltooid, worden gecontroleerd op mogelijke symptomen van CRS (zie rubriek 4.8).
Wanneer Columvi wordt gegeven in combinatie met gemcitabine en oxaliplatine, moeten de patiënten tijdens elke infusie van Columvi en gedurende 4 uur nadat de infusie van de eerste dosis Columvi (2,5 mg op dag 8 van cyclus 1) is voltooid, worden gecontroleerd op mogelijke symptomen van CRS (zie rubriek 4.8).
Patiënten die CRS van graad ≥ 2 hadden bij hun vorige infusie moeten nadat de infusie is voltooid, worden gecontroleerd (zie tabel 4 in rubriek 4.2).
Alle patiënten moeten na toediening van Columvi worden gecontroleerd op tekenen en symptomen van CRS en immuun-effectorcel-geassocieerd neurotoxiciteitssyndroom (ICANS).
Alle patiënten moeten worden voorgelicht over de risico’s, tekenen en symptomen van CRS en ICANS en worden geadviseerd om onmiddellijk contact op te nemen met de zorgverlener als zij, wanneer dan ook, tekenen en symptomen van CRS en/of ICANS ervaren (zie rubriek 4.4).
Duur van de behandeling
Behandeling met Columvi monotherapie wordt aanbevolen gedurende maximaal 12 cycli of tot ziekteprogressie of onbehandelbare toxiciteit, afhankelijk van wat zich het eerst voordoet. Elke cyclus duurt 21 dagen.
Behandeling met Columvi in combinatie met gemcitabine en oxaliplatine wordt aanbevolen gedurende 8 cycli, gevolgd door 4 cycli van Columvi monotherapie met een maximum van 12 cycli Columvi in totaal of tot ziekteprogressie of onbehandelbare toxiciteit, afhankelijk van wat zich het eerst voordoet. Elke cyclus duurt 21 dagen.
Uitgestelde of gemiste doses
Tijdens het doseringsopbouwschema (wekelijkse dosering):
Na voorbehandeling met obinutuzumab, indien de Columvi 2,5 mg-dosis meer dan 1 week wordt uitgesteld: herhaal de voorbehandeling met obinutuzumab.
Na een dosis van 2,5 mg of 10 mg Columvi, indien er een behandelingsvrij interval van Columvi van 2 weken tot 6 weken is: herhaal de laatste getolereerde dosis Columvi en hervat het geplande doseringsopbouwschema.
Na een dosis van 2,5 mg of 10 mg Columvi, indien er een behandelingsvrij interval van Columvi van meer dan 6 weken is: herhaal de voorbehandeling met obinutuzumab en het geplande doseringsopbouwschema van Columvi (zie cyclus 1 in tabel 2 en tabel 3).
Na cyclus 2 (dosis van 30 mg):
Indien er een behandelingsvrij interval van Columvi van meer dan 6 weken tussen de cycli is: herhaal de voorbehandeling met obinutuzumab en het doseringsopbouwschema van Columvi (zie cyclus 1 in tabel 2 en tabel 3) en hervat vervolgens de geplande behandelcyclus (30 mg dosis).
Dosisaanpassingen
Er worden geen dosisverlagingen van Columvi aanbevolen.
Behandeling van ‘cytokine release’-syndroom
CRS moet worden vastgesteld op basis van klinische presentatie (zie rubriek 4.4 en 4.8). Patiënten moeten worden onderzocht voor andere oorzaken van koorts, hypoxie en hypotensie, zoals infecties of sepsis. Als CRS wordt vermoed, moeten patiënten worden behandeld volgens de aanbevelingen voor de behandeling van CRS gebaseerd op consensusgradering volgens American Society for Transplantation and Cellular Therapy (ASTCT) in tabel 4.
Tabel 4 ASTCT-leidraad voor gradering en behandeling van CRS
Graad1 | CRS-management | Voor de volgende geplande Columvi infusie |
Graad 1 | Als CRS optreedt tijdens infusie: | De symptomen moeten ten minste 72 uur vóór de volgende infusie zijn verdwenen |
Graad 2 | Als CRS optreedt tijdens infusie: | De symptomen moeten ten minste 72 uur vóór de volgende infusie zijn verdwenen |
Voor graad 2: behandeling met tocilizumab | ||
Graad 3 | Als CRS optreedt tijdens infusie: | De symptomen moeten ten minste 72 uur vóór de volgende infusie zijn verdwenen |
Graad 4 | Als CRS optreedt tijdens infusie of na infusie: | |
Voor graad 3 en graad 4: behandeling met tocilizumab | ||
1 Criteria ASTCT-consensusgradering (Lee 2019). | ||
Behandeling van immuun-effectorcel-geassocieerd neurotoxiciteitssyndroom (ICANS)
Bij het eerste teken van ICANS moet op basis van het type en de ernst daarvan ondersteunende therapie, neurologische evaluatie en stopzetten van Columvi worden overwogen (zie tabel 5). Sluit andere oorzaken van neurologische symptomen uit. Indien een vermoeden van ICANS bestaat, moet het worden behandeld overeenkomstig de aanbevelingen in tabel 5.
Tabel 5 Leidraad voor gradering en behandeling van ICANS
Graad1 | Symptomen2 | Behandeling van ICANS | |
|
| Gelijktijdig optreden van CRS | Geen gelijktijdig optreden van CRS |
Graad 1 | ICE3-score 7-9 | Behandel CRS volgens tabel 4. | Controleer neurologische symptomen en overweeg consultatie van en beoordeling door een neuroloog, afhankelijk van het oordeel van de arts. |
Stop de behandeling met Columvi totdat ICANS verdwijnt. | |||
Graad 2 | ICE3-score 3-6 | Dien tocilizumab toe volgens tabel 4 voor de behandeling van CRS. | Dien om de 6 uur 10 mg dexamethason5 intraveneus toe. |
Stop de behandeling met Columvi totdat ICANS verdwijnt. | |||
Graad 3 | ICE3-score 0-2 | Dien tocilizumab toe volgens tabel 4 voor de behandeling van CRS. | Dien om de 6 uur 10 mg dexamethason5 intraveneus toe. |
Stop de behandeling met Columvi totdat ICANS verdwijnt. | |||
Graad 4 | ICE3-score 0
|
|
|
Staak de behandeling met Columvi permanent. | |||
1 Consensuscriteria van de ASTCT voor de gradering van ICANS (Lee 2019).
2 De behandeling wordt bepaald door de ernstigste gebeurtenis die niet aan enige andere oorzaak kan worden toegeschreven.
3 Indien de patiënt wakker te krijgen is en in staat is om de beoordeling van immuun-effectorcel-geassocieerde encefalopathie (ICE) uit te voeren, beoordeel dan:
Oriëntatie (oriëntatie in jaar, maand, stad, ziekenhuis = 4 punten);
Benoemen (3 voorwerpen benoemen/aanwijzen, bijv. wijs klok, pen, knoop aan = 3 punten);
Opdrachten uitvoeren (bijv. ‘Steek 2 vingers op’ of ‘Doe uw ogen dicht en steek uw tong uit’ = 1 punt);
Schrijven (vermogen om een standaardzin te schrijven = 1 punt);
Aandacht (vanaf 100 in stappen van tien terugtellen = 1 punt).
Als de patiënt niet wakker te krijgen is en niet in staat is de ICE-beoordeling uit te voeren (graad 4 ICANS) = 0 punten.
4 Niet toe te schrijven aan een andere oorzaak.
5 Alle verwijzingen naar de toediening van dexamethason zijn te lezen als verwijzingen naar dexamethason of een gelijkwaardig geneesmiddel.
Speciale populaties
Ouderen
Er is geen dosisaanpassing nodig bij patiënten van 65 jaar en ouder (zie rubriek 5.2).
Verminderde leverfunctie
Er is geen dosisaanpassing nodig bij patiënten met een licht verminderde leverfunctie (totaalbilirubine > bovengrens van normaal [ULN] tot ≤ 1,5 x ULN of aspartaataminotransferase [ASAT] > ULN). Columvi is niet onderzocht bij patiënten met een matig of ernstig verminderde leverfunctie (zie rubriek 5.2).
Verminderde nierfunctie
Er is geen dosisaanpassing nodig bij patiënten met een licht of matig verminderde nierfunctie (CrCL 30 tot 90 ml/min). Columvi is niet onderzocht bij patiënten met een ernstig verminderde nierfunctie (zie rubriek 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van Columvi bij kinderen jonger dan 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Columvi is uitsluitend voor intraveneus gebruik.
Voorafgaand aan intraveneuze toediening moet Columvi met een aseptische techniek worden verdund door een beroepsbeoefenaar in de gezondheidszorg. Het moet worden toegediend als een intraveneuze infusie via een aparte infuuslijn.
Columvi mag niet worden toegediend als een intraveneuze push of bolus.
Voor instructies over verdunning van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof, voor obinutuzumab of voor een van de in rubriek 6.1 vermelde hulpstof(fen).
Raadpleeg de Samenvatting van Productkenmerken van obinutuzumab voor specifieke contra-indicaties voor obinutuzumab.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Columvi monotherapie
De meest voorkomende bijwerkingen (≥ 20%) waren ‘cytokine release’-syndroom, neutropenie, anemie, trombocytopenie en huiduitslag.
De meest voorkomende ernstige bijwerkingen die bij ≥ 2% van de patiënten werden gemeld, waren ‘cytokine release’-syndroom (22,1%), sepsis (4,1%), COVID-19 (3,4%), tumor flare (3,4%), COVID-19-pneumonie (2,8%), febriele neutropenie (2,1%), neutropenie (2,1%) en pleurale effusie (2,1%).
Bij 5,5% van de patiënten werd Columvi definitief gestaakt als gevolg van een bijwerking. De meest voorkomende bijwerkingen die tot definitieve stopzetting van Columvi leidden waren COVID-19 (1,4%) en neutropenie (1,4%).
Columvi in combinatie met gemcitabine en oxaliplatine
De meest voorkomende bijwerkingen (≥ 20%) waren trombocytopenie, ‘cytokine release’-syndroom, neutropenie, anemie, misselijkheid, perifere neuropathie, diarree, verhoogd aspartaataminotransferase, verhoogd alanine-aminotransferase, huiduitslag, lymfopenie, pyrexie en braken.
De meest voorkomende ernstige bijwerkingen die bij ≥ 2% van de patiënten werden gemeld, waren ‘cytokine release-syndroom’ (20,3%), pyrexie (6,4%), pneumonie (5,8%), COVID-19 (5,8%), trombocytopenie (4,7%), luchtweginfectie (3,5%), sepsis (2,3%), febriele neutropenie (2,3%) en diarree (2,3%).
Bij 20,9% van de patiënten werd Columvi definitief gestaakt als gevolg van een bijwerking. De meest voorkomende bijwerkingen die tot definitieve stopzetting van Columvi leidden waren COVID-19 (11,6%), sepsis (1,2%) en pneumonitis (1,2%).
Tabel met lijst van bijwerkingen
De bijwerkingen die voorkwamen bij patiënten met recidiverend of refractair DLBCL die werden behandeld met Columvi als monotherapie (n = 145) in onderzoek NP30179 staan vermeld in tabel 6. Het mediane aantal behandelingscycli met Columvi was 5 (bereik: 1 tot 13 cycli).
De bijwerkingen die voorkwamen bij patiënten met recidiverend of refractair DLBCL die werden behandeld met Columvi in combinatie met gemcitabine en oxaliplatine (n = 172) in onderzoek GO41944 (STARGLO) staan vermeld in tabel 7. Het mediane aantal behandelingscycli met Columvi was 11 (bereik: 1 tot 13 cycli).
De bijwerkingen worden vermeld per MedDRA-systeem/orgaanklasse en per frequentiecategorie weergegeven. De volgende frequentiecategorieën zijn gebruikt: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000) en zeer zelden (< 1/10.000). Binnen elke frequentiecategorie worden bijwerkingen weergegeven in volgorde van afnemende ernst.
Tabel 6 Bijwerkingen die optraden bij patiënten met recidiverend of refractair DLBCL die werden behandeld met Columvi als monotherapie
Systeem/orgaanklasse | Bijwerking | Alle graden | Graad 3 – 4 |
Infecties en parasitaire aandoeningen | Virale infecties1 | Zeer vaak | Vaak* |
Bacteriële infecties2 | Vaak | Vaak | |
Bovensteluchtweginfecties3 | Vaak | Zeer zelden** | |
Sepsis4 | Vaak | Vaak* | |
Ondersteluchtweginfecties5 | Vaak | Zeer zelden** | |
Pneumonie | Vaak | Soms | |
Urineweginfectie6 | Vaak | Soms | |
Schimmelinfecties7 | Vaak | Zeer zelden** | |
Neoplasmata, benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) | Tumor flare | Zeer vaak | Vaak |
Bloed- en lymfestelselaandoeningen | Neutropenie | Zeer vaak | Zeer vaak |
Anemie | Zeer vaak | Vaak | |
Trombocytopenie | Zeer vaak | Vaak | |
Lymfopenie | Vaak | Vaak | |
Febriele neutropenie8 | Vaak | Vaak | |
Immuunsysteem-aandoeningen | ‘Cytokine release’-syndroom9 | Zeer vaak | Vaak |
Voedings- en stofwisselingsstoornissen | Hypofosfatemie | Zeer vaak | Vaak |
Hypomagnesiëmie | Zeer vaak | Zeer zelden** | |
Hypocalciëmie | Zeer vaak | Zeer zelden** | |
Hypokaliëmie | Zeer vaak | Soms | |
Hyponatriëmie | Vaak | Vaak | |
Tumorlysissyndroom | Vaak | Vaak | |
Psychische stoornissen | Verwarde toestand | Vaak | Zeer zelden** |
Zenuwstelselaandoeningen | Hoofdpijn | Zeer vaak | Zeer zelden** |
Immuun-effectorcel-geassocieerd neurotoxiciteitssyndroom10 | Vaak | Soms* | |
Somnolentie | Vaak | Soms | |
Tremor | Vaak | Zeer zelden** | |
Myelitis11 | Soms | Soms | |
Maagdarmstelsel-aandoeningen | Constipatie | Zeer vaak | Zeer zelden** |
Diarree | Zeer vaak | Zeer zelden** | |
Misselijkheid | Zeer vaak | Zeer zelden** | |
Gastro-intestinale bloeding12 | Vaak | Vaak | |
Braken | Vaak | Zeer zelden** | |
Colitis | Soms | Soms | |
Huid- en onderhuidaandoeningen | Huiduitslag13 | Zeer vaak | Vaak |
Algemene aandoeningen en toedieningsplaats-stoornissen | Pyrexie | Zeer vaak | Zeer zelden** |
Onderzoeken | Alanine-aminotransferase verhoogd | Vaak | Vaak |
Aspartaataminotransferase verhoogd | Vaak | Vaak | |
Bloed alkalische fosfatase verhoogd | Vaak | Vaak | |
Gamma-glutamyltransferase verhoogd | Vaak | Vaak | |
Bloed bilirubine verhoogd | Vaak | Soms | |
Verhoogde leverenzymen | Vaak | Vaak |
* Bijwerkingen van graad 5 gemeld. Zie Beschrijving van geselecteerde bijwerkingen.
** Er werden geen graad 3-4 bijwerkingen gemeld.
1 Omvat COVID-19, COVID-19-pneumonie, herpes zoster, influenza en oftalmische herpes zoster.
2 Omvat infectie van het vasculaire hulpmiddel, bacteriële infectie, Campylobacter-infectie, galweginfectie bacterieel, urineweginfectie bacterieel, Clostridium difficile-infectie, Escherichia-infectie en peritonitis.
3 Omvat bovensteluchtweginfectie, sinusitis, nasofaryngitis, chronische sinusitis en rhinitis.
4 Omvat sepsis en septische shock.
5 Omvat ondersteluchtweginfectie en bronchitis.
6 Omvat urineweginfectie en Escherichia urineweginfectie.
7 Omvat oesofageale candidiasis en orale candidiasis.
8 Omvat febriele neutropenie en neutropenische infectie.
9 Gebaseerd op ASTCT-consensusgradering (Lee 2019).
10 ICANS volgens Lee 2019 en omvat somnolentie, cognitieve stoornis, verwarde toestand, delirium en desoriëntatie.
11 Myelitis trad gelijktijdig op met CRS.
12 Omvat gastro-intestinale bloeding, dikkedarmbloeding en maagbloeding.
13 Omvat huiduitslag, pruritische huiduitslag, maculopapuleuze huiduitslag, dermatitis, acneïforme dermatitis, exfoliatieve dermatitis, erytheem, palmerytheem, pruritis en erythemateuze huiduitslag.
Tabel 7. Bijwerkingen die optraden bij patiënten met recidiverend of refractair DLBCL die werden behandeld met Columvi in combinatie met gemcitabine en oxaliplatine
Systeem/orgaanklasse | Bijwerking | Alle graden | Graad 3-4 |
Infecties en parasitaire aandoeningen | COVID-191 | Zeer vaak | Vaak* |
Luchtweginfecties2 | Zeer vaak | Vaak* | |
Pneumonie3 | Zeer vaak | Vaak* | |
Cytomegalovirusinfecties4 | Vaak | Soms | |
Herpesvirusinfecties5 | Vaak | Soms | |
Urineweginfectie6 | Vaak | Vaak | |
Sepsis7 | Vaak | Vaak* | |
Candida-infecties8 | Vaak | Zeer zelden** | |
Pneumocystis jirovecii-pneumonie | Soms | Soms | |
Neoplasmata, benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) | Tumor flare9 | Vaak | Zeer zelden** |
Bloed- en lymfestelselaandoeningen | Trombocytopenie | Zeer vaak | Zeer vaak |
Neutropenie | Zeer vaak | Zeer vaak | |
Anemie | Zeer vaak | Zeer vaak | |
Lymfopenie | Zeer vaak | Zeer vaak | |
Febriele neutropenie | Vaak | Vaak | |
Immuunsysteemaandoeningen | ‘Cytokine release’-syndroom10 | Zeer vaak | Vaak |
Voedings- en stofwisselingsstoornissen | Hypokaliëmie | Zeer vaak | Vaak |
Hyponatriëmie | Zeer vaak | Soms | |
Hypomagnesiëmie | Vaak | Zeer zelden** | |
Hypocalciëmie | Vaak | Soms | |
Hypofosfatemie | Vaak | Vaak | |
Tumorlysissyndroom | Vaak | Vaak | |
Zenuwstelselaandoeningen | Perifere neuropathie11 | Zeer vaak | Vaak |
Immuun-effectorcel-geassocieerd neurotoxiciteitssyndroom12 | Vaak | Soms | |
Hoofdpijn | Vaak | Zeer zelden** | |
Tremor | Soms | Zeer zelden** | |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Pneumonitis | Vaak | Zeer zelden*,** |
Maagdarmstelselaandoeningen | Misselijkheid | Zeer vaak | Soms |
Diarree | Zeer vaak | Vaak | |
Braken | Zeer vaak | Soms | |
Buikpijn13 | Zeer vaak | Vaak | |
Constipatie | Zeer vaak | Zeer zelden** | |
Colitis14 | Vaak | Vaak | |
Pancreatitis15 | Vaak | Vaak | |
Huid- en onderhuidaandoeningen | Huiduitslag16 | Zeer vaak | Soms |
Skeletspierstelsel- en bindweefselaandoeningen | Skeletspierstelselpijn17 | Zeer vaak | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Pyrexie | Zeer vaak | Soms |
Onderzoeken | Aspartaataminotransferase verhoogd | Zeer vaak | Vaak |
Alanine-aminotransferase verhoogd | Zeer vaak | Vaak | |
Bloed alkalische fosfatase verhoogd | Zeer vaak | Soms | |
Gamma-glutamyltransferase verhoogd | Zeer vaak | Vaak | |
Bloed lactaatdehydrogenase verhoogd | Zeer vaak | Zeer zelden** | |
Bloed bilirubine verhoogd18 | Vaak | Zeer zelden** | |
Verhoogde leverenzymen | Soms | Zeer zelden** |
* Bijwerkingen van graad 5 gemeld. Zie Beschrijving van geselecteerde bijwerkingen.
** Er werden geen graad 3-4 bijwerkingen gemeld.
1 Omvat COVID-19-, COVID-19-pneumonie en SARS-CoV-2-test positief.
2 Omvat bovensteluchtweginfectie, ondersteluchtweginfectie, luchtweginfectie en bacteriële luchtweginfectie.
3 Omvat pneumonie, bacteriële pneumonie en pneumokokkenpneumonie.
4 Nieuw ontstaan of reactivering. Omvat cytomegalovirusinfectie, cytomegalovirustest positief, reactivering van cytomegalovirusinfectie en cytomegalovirus-viremie.
5 Nieuw ontstaan of reactivering. Omvat herpes zoster en herpesvirusinfectie.
6 Omvat urineweginfectie en urosepsis.
7 Omvat sepsis, streptokokkensepsis, septische shock en enterokokkensepsis.
8 Omvat orale candidiasis en candida-infectie.
9 Omvat tumor flare en tumorpijn.
10 Gebaseerd op ASTCT-consensusgradering (Lee 2019).
11 Omvat perifere neuropathie, perifere sensorische neuropathie, dysesthesie, paresthesie, hypo-esthesie, perifere motorische neuropathie en polyneuropathie.
12 Omvat verwarde toestand, delirium en ICANS.
13 Omvat buikpijn, abdominaal ongemak, pijn in de bovenbuik, pijn in de onderbuik en gastro-intestinale pijn.
14 Omvat colitis, ischemische colitis en enterocolitis.
15 Omvat pancreatitis en acute pancreatitis.
16 Omvat huiduitslag, pruritische huiduitslag, maculopapuleuze huiduitslag, erytheem, pruritus, erythemateuze huiduitslag, urticaria en erythema multiforme.
17 Omvat artralgie, pijn in het skeletspierstelsel, rugpijn, botpijn, myalgie, nekpijn, pijn in extremiteiten, skeletspierstelsel borstpijn en niet-cardiale pijn op de borst.
18 Omvat bloed bilirubine verhoogd en hyperbilirubinemie.
Beschrijving van geselecteerde bijwerkingen
De onderstaande beschrijvingen geven informatie over belangrijke bijwerkingen van Columvi monotherapie en/of combinatietherapie. Details over de belangrijke bijwerkingen van Columvi wanneer gegeven in combinatie, worden afzonderlijk weergegeven indien klinisch relevante verschillen zijn waargenomen ten opzichte van Columvi monotherapie.
‘Cytokine release’-syndroom
Columvi monotherapie
CRS van alle graden (volgens ASTCT-criteria) trad op bij 67,6% van de patiënten die Columvi monotherapie kregen, waarbij CRS van graad 1 werd gemeld bij 50,3% van de patiënten, CRS van graad 2 bij 13,1% van de patiënten, CRS van graad 3 bij 2,8% van de patiënten en CRS van graad 4 bij 1,4% van de patiënten. CRS trad meer dan één keer op bij 32,4% (47/145) van de patiënten; 36/47 patiënten kregen alleen meerdere CRS-voorvallen van graad 1. Er waren geen fatale gevallen van CRS. CRS herstelde bij alle patiënten op één na. Eén patiënt stopte met de behandeling vanwege CRS.
De meest voorkomende manifestaties bij patiënten met CRS waren pyrexie (99,0%), tachycardie (25,5%), hypotensie (23,5%), koude rillingen (14,3%) en hypoxie (12,2%). Voorvallen van graad 3 of hoger geassocieerd met CRS omvatten hypotensie (3,1%), hypoxie (3,1%), pyrexie (2,0%) en tachycardie (2,0%).
CRS, ongeacht de graad, trad op bij 54,5% van de patiënten na de eerste dosis van 2,5 mg Columvi op dag 8 van cyclus 1, met een mediane tijd tot ontstaan (vanaf het begin van de infusie) van 12,6 uur (bereik: 5,2 tot 50,8 uur) en mediane duur van 31,8 uur (bereik: 0,5 tot 316,7 uur); bij 33,3% van de patiënten na de dosis van 10 mg op dag 15 van cyclus 1, met een mediane tijd tot ontstaan van 26,8 uur (bereik: 6,7 tot 125,0 uur) en mediane duur van 16,5 uur (bereik: 0,3 tot 109,2 uur); en bij 26,8% van de patiënten na de dosis van 30 mg in cyclus 2 met een mediane tijd tot ontstaan van 28,2 uur (bereik: 15,0 tot 44,2 uur) en mediane duur van 18,9 uur (bereik: 1,0 tot 180,5 uur). CRS werd gemeld bij 0,9% van de patiënten in cyclus 3 en bij 2% van de patiënten na cyclus 3.
CRS van graad 2 trad op bij 12,4% van de patiënten na de eerste dosis Columvi (2,5 mg) met een mediane tijd tot ontstaan van 9,7 uur (bereik: 5,2 tot 19,1 uur) en een mediane duur van 50,4 uur (bereik: 6,5 tot 316,7 uur). Na de dosis van 10 mg Columvi op dag 15 van cyclus 1 nam de incidentie van CRS van graad 2 af tot 5,2% van de patiënten met een mediane tijd tot ontstaan van 26,2 uur (bereik: 6,7 tot 144,2 uur) en een mediane duur van 30,9 uur (bereik: 3,7 tot 227,2 uur). CRS van graad 2 trad op bij één patiënt (0,8%) na een dosis van 30 mg Columvi op dag 1 van cyclus 2 met een tijd tot ontstaan van 15,0 uur en een duur van 44,8 uur. Er werd geen CRS van graad 2 gemeld na cyclus 2.
Van de 145 patiënten hadden 7 patiënten (4,8%) verhoogde leverfunctietestwaarden (ASAT en ALAT > 3 ULN en/of totaalbilirubine > 2 ULN) die gelijktijdig werden gemeld met CRS (n = 6) of met ziekteprogressie (n = 1).
Van de 25 patiënten met CRS van graad 2 na toediening van Columvi, kregen 22 (88,0%) patiënten tocilizumab, 15 (60,0%) patiënten kregen corticosteroïden en 14 (56,0%) patiënten kregen zowel tocilizumab als corticosteroïden. Tien patiënten (40,0%) kregen zuurstof. Alle 6 (24,0%) patiënten met CRS van graad 3 of 4 kregen één vasopressor.
Ziekenhuisopnames van patiënten als gevolg van het optreden van CRS na toediening van Columvi traden op bij 22,1% van de patiënten en de mediane duur van ziekenhuisopname was 4 dagen (bereik: 2 tot 15 dagen).
Columvi in combinatie met gemcitabine en oxaliplatine
CRS van alle graden (volgens ASTCT-criteria) trad op bij 44,2% van de patiënten die Columvi met gemcitabine en oxaliplatine kregen, waarbij CRS van graad 1 werd gemeld bij 31,4% van de patiënten, CRS van graad 2 bij 10,5% van de patiënten en CRS van graad 3 bij 2,3% van de patiënten. CRS trad meer dan één keer op bij 21,5% (37/172) van de patiënten; 30/37 patiënten kregen meerdere CRS-voorvallen van alleen graad 1. Er waren geen graad 4 of fatale gevallen van CRS. CRS herstelde bij alle patiënten op één na. Eén patiënt stopte met de behandeling vanwege CRS.
De meest voorkomende symptomen bij patiënten met CRS waren pyrexie (98,7%), hypotensie (22,4%), koude rillingen (17,1%) en hypoxie (14,5%). Voorvallen van graad 3 of hoger geassocieerd met CRS omvatten hypotensie (6,6%), hypoxie (5,3%), pyrexie (3,9%), koude rillingen (1,3%) en diarree (1,3%).
CRS, ongeacht de graad, trad op bij 34,9% van de patiënten na de eerste dosis van 2,5 mg Columvi op dag 8 van cyclus 1, met een mediane tijd tot ontstaan (vanaf het begin van de infusie) van 12,6 uur (bereik: 4,4 tot 54,7 uur) en mediane duur van 19,8 uur (bereik: 2,0 tot 168,0 uur); bij 14,4% van de patiënten na de dosis van 10 mg op dag 15 van cyclus 1, met een mediane tijd tot ontstaan van 22,8 uur (bereik: 7,4 tot 81,2 uur) en een mediane duur van 10,6 uur (bereik: 1,0 tot 248,5 uur) en bij 9,3% van de patiënten na de dosis van 30 mg in cyclus 2 met een mediane tijd tot ontstaan van 23,5 uur (bereik: 14,7 tot 33,4 uur) en een mediane duur van 18,4 uur (bereik: 8,3 tot 137,0 uur). CRS werd gemeld bij 6,7% van de patiënten in cyclus 3 en bij 11,0% van de patiënten na cyclus 3.
CRS van graad 2 trad op bij 10,5% van de patiënten na de eerste dosis Columvi (2,5 mg) met een mediane tijd tot ontstaan van 12,0 uur (bereik: 4,4 tot 30,5 uur) en een mediane duur van 42,3 uur (bereik: 3,5 tot 143,7 uur). Bij de meerderheid (14/18) van de patiënten die CRS graad 2 kregen, begon CRS binnen 8 uur na de start van de eerste dosis Columvi (2,5 mg) of deed zich koorts voor ≥ 1,5 uur voorafgaand aan het optreden van andere symptomen van CRS graad 2. Na de dosis van 10 mg Columvi op dag 15 van cyclus 1 nam de incidentie van CRS van graad 2 af tot 1,8% van de patiënten met een mediane tijd tot ontstaan van 22,3 uur (bereik: 7,4 tot 22,8 uur) en een mediane duur van 37,0 uur (bereik: 34,8 tot 248,5 uur). Er waren geen voorvallen van CRS van graad 2 na een dosis van 30 mg Columvi op dag 1 van cyclus 2. Drie patiënten (2,0%) hadden CRS van graad 2 CRS na cyclus 2 (alle voorvallen waren van graad 2).
Van de 172 patiënten hadden 2 patiënten (1,2%) verhoogde leverfunctietestwaarden (ASAT en ALAT > 3 × ULN) die gelijktijdig werden gemeld met CRS.
Van de 76 patiënten met CRS van alle graden werden 28 patiënten (36,8%) behandeld met tocilizumab, 39 patiënten (51,3%) werden behandeld met corticosteroïden en 18 patiënten (23,7%) kregen zowel tocilizumab als corticosteroïden.
Van de 22 patiënten met CRS van graad 2 na toediening van Columvi, kregen 16 patiënten (72,7%) tocilizumab, 15 patiënten (68,2%) kregen corticosteroïden en 12 patiënten (54,5%) kregen zowel tocilizumab als corticosteroïden. Elf patiënten (50,0%) kregen zuurstof. Alle 4 patiënten (18,2%) met CRS van graad 3 kregen één vasopressor.
Ziekenhuisopnames van patiënten als gevolg van het optreden van CRS na toediening van Columvi traden op bij 19,8% van de patiënten en de mediane duur van ziekenhuisopname was 5 dagen (bereik: 2 tot 85 dagen).
Immuun-effectorcel-geassocieerd neurotoxiciteitssyndroom
Gevallen van ICANS, met inbegrip van graad 3 en hoger, zijn gemeld in klinische proeven en hebben zich voorgedaan na het in de handel brengen. De meest voorkomende klinische verschijnselen van ICANS waren verwardheid, verminderd bewustzijn, desoriëntatie, insult, afasie en dysgrafie. Op basis van de beschikbare gegevens werd het optreden van neurologische toxiciteit in de meeste gevallen gelijktijdig met CRS waargenomen.
Het merendeel van de waargenomen gevallen van ICANS deed zich voor na 1 tot 7 dagen, met een mediaan van 2 dagen, na de meest recente dosis. Er zijn slechts enkele gevallen gemeld die zich meer dan een maand na aanvang van de behandeling met Columvi hebben voorgedaan.
Ernstige infecties
Ernstige infecties werden gemeld bij 15,9% van de patiënten die werden behandeld met Columvi monotherapie. De vaakst voorkomende ernstige infecties die werden gemeld bij ≥ 2% van de patiënten waren sepsis (4,1%), COVID-19 (3,4%) en COVID-19-pneumonie (2,8%). Infectiegerelateerde sterfgevallen werden gemeld bij 4,8% van de patiënten (als gevolg van sepsis, COVID-19-pneumonie en COVID-19). Vier patiënten (2,8%) kregen ernstige infecties gelijktijdig met neutropenie van graad 3 of 4.
Ernstige infecties werden gemeld bij 22,7% van de patiënten die Columvi met gemcitabine en oxaliplatine kregen. De meest voorkomende ernstige infecties die werden gemeld bij ≥ 2% van de patiënten waren pneumonie (5,8%), COVID-19 (4,7%) en ondersteluchtweginfectie (2,9%). Infectiegerelateerde sterfgevallen werden gemeld bij 3,5% van de patiënten (als gevolg van COVID‑19, pneumonie, luchtweginfectie en septische shock). Eén patiënt (0,6%) kreeg een ernstige infectie (pneumonie) gelijktijdig met neutropenie van graad 3.
Pneumonitis
Voorvallen van pneumonitis (met uitzondering van pneumonie met infectieuze etiologie) werden gemeld bij 2 patiënten (1,2%) die Columvi met gemcitabine en oxaliplatine kregen, waarvan beide fatale voorvallen waren. De mediane tijd tot het ontstaan van pneumonitis vanaf de eerste dosis Columvi was 168 dagen (bereik: 102 tot 255 dagen).
Colitis
Colitis (graad 4) werd gemeld bij 1 patiënt (0,7%) die Columvi als monotherapie kreeg, met tijd tot aanvang vanaf de eerste dosis Columvi van 104 dagen.
Voorvallen van Colitis (met uitzondering met infectieuze etiologie) werden gemeld bij 4/172 patiënten (2,3%) die Columvi met gemcitabine en oxaliplatine kregen. Twee patiënten (1,2%) hadden voorvallen van graad 3. De mediane tijd tot het ontstaan van colitis vanaf de eerste dosis Columvi was 154 dagen (bereik: 115 tot 187 dagen).
Opportunistische infecties
CMV-voorvallen werden gemeld bij 6/467 patiënten (1,3%) die Columvi als monotherapie kregen, waarbij 1 patiënt (0,2%) CMV-chorioretinitis van graad 3 had. Pneumocystis jiroveci-pneumonie werd gemeld bij 4/467 patiënten (0,9%), van wie er 3 (0,6%) voorvallen van graad 3 hadden.
CMV-voorvallen werden gemeld bij 11 patiënten (6,4%) die Columvi met gemcitabine en oxaliplatine kregen, waarbij 1 patiënt (0,6%) CMV-viremie van graad 3 had. Orale candidiasis werd gemeld bij 3 patiënten (1,7%), dit waren allemaal voorvallen van graad 1-2. Pneumocystis jirovecii-pneumonie (graad 3) werd gemeld bij 1 patiënt (0,6%), dit was dezelfde patiënt met CMV-viremie van graad 3. Borrelia-meningitis (graad 2) werd gemeld bij 1 patiënt (0,6%).
Neutropenie
Neutropenie (waaronder afname in aantal neutrofielen) werd gemeld bij 40,0% van de patiënten en ernstige neutropenie (graad 3 of 4) werd gemeld bij 29,0% van de patiënten die werden behandeld met Columvi monotherapie. De mediane tijd tot het eerste optreden van neutropenie was 29 dagen (bereik: 1 tot 203 dagen). Langdurige neutropenie (langer dan 30 dagen) trad op bij 11,7% van de patiënten. De meerderheid van de patiënten met neutropenie (79,3%) werd behandeld met G-CSF. Febriele neutropenie werd gemeld bij 3,4% van de patiënten.
Tumor flare
Tumor flare werd gemeld bij 11,7% van de patiënten die werden behandeld met Columvi monotherapie, waaronder graad 2 tumor flare bij 4,8% van de patiënten en graad 3 tumor flare bij 2,8% van de patiënten. Tumor flare werd gemeld waarbij lymfeklieren in het hoofd en de hals betrokken waren, gepaard gaande met pijn, en waarbij lymfeklieren in de thorax betrokken waren, gepaard gaande met symptomen van kortademigheid als gevolg van ontwikkeling van pleurale effusie. De meeste voorvallen van tumor flare (16/17) traden op tijdens cyclus 1, en er werden geen voorvallen van tumor flare gemeld na cyclus 2. De mediane tijd tot ontstaan van tumor flare, ongeacht de graad, was 2 dagen (bereik: 1 tot 16 dagen) en de mediane duur was 3,5 dagen (bereik: 1 tot 35 dagen).
Van de 11 patiënten die een tumor flare van graad ≥ 2 ondervonden, kregen 2 patiënten (18,2%) analgetica, 6 patiënten (54,5%) kregen corticosteroïden en analgetica waaronder morfinederivaten, 1 patiënt (9,1%) kreeg corticosteroïden en anti-emetica en 2 patiënten (18,2%) hadden geen behandeling nodig. Alle voorvallen van tumor flare verdwenen, behalve bij één patiënt met een voorval van graad ≥ 2. Er waren geen patiënten die de behandeling staakten als gevolg van tumor flare.
Tumorlysissyndroom (TLS)
TLS werd gemeld bij 2 patiënten (1,4%) die werden behandeld met Columvi monotherapie en was in beide gevallen graad 3 van ernst. De mediane tijd tot ontstaan van TLS was 2 dagen en de mediane duur was 4 dagen (bereik: 3 tot 5 dagen).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/23/1742/001
EU/1/23/1742/002
10. DATUM VAN HERZIENING VAN DE TEKST
24 juli 2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4729232 | Columvi 2,5 mg concentraat voor oplossing voor infusie | - | € 774 | Ja | - | - | |
| 4729240 | Columvi 10 mg concentraat voor oplossing voor infusie | - | € 3095 | Ja | - | - |