1. NAAM VAN HET GENEESMIDDEL
Abraxane 5 mg/ml poeder voor dispersie voor infusie.
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke injectieflacon bevat 100 mg paclitaxel geformuleerd als albumine‑gebonden nanodeeltjes.
Elke injectieflacon bevat 250 mg paclitaxel geformuleerd als albumine‑gebonden nanodeeltjes.
Na reconstitutie bevat elke ml dispersie 5 mg paclitaxel geformuleerd als albumine‑gebonden nanodeeltjes.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder voor dispersie voor infusie.
Na reconstitutie heeft de dispersie een pH van 6‑7,5 en een osmolaliteit van 300‑360 mOsm/kg.
Het poeder is wit tot geel.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Abraxane monotherapie is geïndiceerd voor de behandeling van gemetastaseerd mammacarcinoom bij volwassen patiënten bij wie de eerstelijnsbehandeling voor gemetastaseerde ziekte heeft gefaald en voor wie een standaardbehandeling met anthracycline niet geïndiceerd is (zie rubriek 4.4).
Abraxane in combinatie met gemcitabine is geïndiceerd voor de eerstelijnsbehandeling van volwassen patiënten met gemetastaseerd adenocarcinoom van de pancreas.
Abraxane in combinatie met carboplatine is geïndiceerd voor de eerstelijnsbehandeling van niet‑kleincellige longkanker bij volwassen patiënten die niet in aanmerking komen voor potentieel curatieve chirurgie en/of radiotherapie.
4.2 Dosering en wijze van toediening
Abraxane dient alleen onder toezicht van een gekwalificeerde oncoloog te worden toegediend op afdelingen die zijn gespecialiseerd in het toedienen van cytotoxische middelen. Het dient niet te worden vervangen door of gebruikt ter vervanging van andere formuleringen van paclitaxel.
Dosering
Borstkanker
De aanbevolen dosis Abraxane is 260 mg/m2, elke 3 weken gedurende 30 minuten intraveneus toegediend.
Dosisaanpassing tijdens de behandeling van borstkanker
Voor patiënten die ernstige neutropenie (aantal neutrofielen < 500 cellen/mm3 gedurende een week of langer) of ernstige sensorische neuropathie ondervinden tijdens de behandeling met Abraxane, dient de dosering verlaagd te worden tot 220 mg/m2 voor volgende kuren. Als opnieuw ernstige neutropenie of ernstige sensorische neuropathie optreedt, dient de dosis nogmaals verlaagd te worden tot 180 mg/m2. Abraxane mag pas weer worden toegediend nadat het aantal neutrofielen hersteld is tot > 1500 cellen/mm3. Voor graad 3 sensorische neuropathie dient de behandeling te worden gestaakt tot een herstel tot graad 1 of 2, gevolgd door een dosisvermindering voor alle volgende kuren.
Adenocarcinoom van de pancreas
De aanbevolen dosis Abraxane in combinatie met gemcitabine is 125 mg/m2 gedurende 30 minuten intraveneus toegediend op Dag 1, 8 en 15 van elke cyclus van 28 dagen. De gelijktijdig aanbevolen dosis gemcitabine is 1000 mg/m2 gedurende 30 minuten intraveneus toegediend onmiddellijk na afloop van de Abraxane‑toediening op Dag 1, 8 en 15 van elke cyclus van 28 dagen.
Dosisaanpassing tijdens de behandeling van adenocarcinoom van de pancreas
Tabel 1: Verlaging van het dosisniveau voor patiënten met adenocarcinoom van de pancreas
Dosisniveau | Abraxane‑dosis (mg/m2) | Gemcitabine‑dosis (mg/m2) |
Volledige dosis | 125 | 1000 |
1e verlaging van het dosisniveau | 100 | 800 |
2e verlaging van het dosisniveau | 75 | 600 |
Indien verdere dosisverlaging noodzakelijk is | Behandeling stoppen | Behandeling stoppen |
Tabel 2: Dosisveranderingen voor neutropenie en/of trombocytopenie bij aanvang van een cyclus of tijdens een cyclus voor patiënten met adenocarcinoom van de pancreas
Cyclus-dag | ANC‑telling (cellen/mm3) |
| Trombocytentelling (cellen/mm3) | Abraxane‑dosis | Gemcitabine-dosis |
Dag 1 | < 1500 | OF | < 100.000 | Doses uitstellen tot herstel | |
Dag 8 | ≥ 500 maar < 1000 | OF | ≥ 50.000 maar < 75.000 | Doses 1 dosisniveau verlagen | |
| < 500 | OF | < 50.000 | Doses niet geven | |
Dag 15: Als de doses van Dag 8 ongewijzigd werden gegeven: | |||||
Dag 15 | ≥ 500 maar < 1000 | OF | ≥ 50.000 maar < 75.000 | Behandel met het dosisniveau van Dag 8 met daarna WBC‑groeifactoren | |
| < 500 | OF | < 50.000 | Doses niet geven | |
Dag 15: Als de doses van Dag 8 werden verlaagd: | |||||
Dag 15 | ≥ 1000 | EN | ≥ 75.000 | Ga terug naar het dosisniveau van Dag 1 met daarna WBC‑groeifactoren | |
| ≥ 500 maar < 1000 | OF | ≥ 50.000 maar < 75.000 | Behandel met het dosisniveau van Dag 8 met daarna WBC‑groeifactoren | |
| < 500 | OR | < 50.000 | Doses niet geven | |
Dag 15: Als de doses van Dag 8 niet werden gegeven: | |||||
Dag 15 | ≥ 1000 | EN | ≥ 75.000 | Ga terug naar het dosisniveau van Dag 1 met daarna WBC‑groeifactoren | |
| ≥ 500 maar < 1000 | OF | ≥ 50.000 maar < 75.000 | Verlaag met 1 dosisniveau met daarna WBC‑groeifactoren | |
| < 500 | OF | < 50.000 | Doses niet geven | |
Afkortingen: ANC = absolute neutrofielentelling (ANC = Absolute Neutrophil Count); WBC = witte bloedcel
Tabel 3: Dosisveranderingen voor andere bijwerkingen bij patiënten met adenocarcinoom van de pancreas
Bijwerking | Abraxane‑dosis | Gemcitabine‑dosis |
Febriele neutropenie: | De doses niet geven totdat de koorts is verdwenen en ANC ≥ 1500; hervat de behandeling met het eerstvolgende lagere dosisniveaua | |
Perifere neuropathie: | De dosis niet geven totdat er een verbetering optreedt ≤ graad 1; | Behandel met dezelfde dosis |
Huidtoxiciteit: | Verlaag met 1 dosisniveaua; | |
Gastro‑intestinale toxiciteit: | De doses niet geven totdat er een verbetering optreedt naar ≤ graad 1; | |
a Zie Tabel 1 voor verlagingen van het dosisniveau
Niet‑kleincellige longkanker:
De aanbevolen dosering Abraxane is 100 mg/m2 toegediend als een intraveneuze infusie gedurende 30 minuten op Dag 1, 8 en 15 van elke cyclus van 21 dagen. De aanbevolen dosering carboplatine is AUC = 6 mg•min/ml alleen op Dag 1 van elke cyclus van 21 dagen, die onmiddellijk na afloop van de toediening van Abraxane begint.
Dosisaanpassingen tijdens de behandeling van niet‑kleincellige longkanker:
Abraxane mag pas worden toegediend op Dag 1 van een cyclus als de absolute neutrofielentelling (ANC) ≥ 1500 cellen/mm3 en de trombocytentelling ≥ 100.000 cellen/mm3 is. Voor elke opeenvolgende wekelijkse dosis Abraxane moet de patiënt een ANC ≥ 500 cellen/mm3 en een trombocytentelling > 50.000 cellen/mm3 hebben. Anders moet de dosis uitgesteld worden totdat de waarden zijn hersteld. Wanneer de waarden zijn hersteld, kan de toediening de volgende week worden hervat volgens de criteria in Tabel 4. De volgende dosering mag alleen worden verlaagd wanneer aan de criteria in Tabel 4 is voldaan.
Tabel 4: Dosisverlagingen voor hematologische toxiciteit bij patiënten met niet‑kleincellige longkanker
Hematologische toxiciteit | Voorval | Dosis Abraxane | Dosis carboplatine |
Dalwaarde ANC < 500/mm3 met neutropene koorts > 38°C
Volgende cyclus uitgesteld vanwege persisterende neutropenie2 (Dalwaarde ANC < 1500/mm3)
Dalwaarde ANC < 500/mm3 gedurende > 1 week | Eerste | 75 | 4,5 |
Tweede | 50 | 3,0 | |
Derde | Behandeling stoppen | ||
Dalwaarde trombocytenaantal < 50.000/mm3 | Eerste | 75 | 4,5 |
Tweede | Behandeling stoppen | ||
1Op Dag 1 van de cyclus van 21 dagen de dosering van Abraxane en carboplatine gelijktijdig verlagen. Op Dag 8 of 15 van de cyclus van 21 dagen de Abraxane‑dosering verlagen; de carboplatine‑dosering in de volgende cyclus verlagen.
2Maximaal 7 dagen na de geplande dosering op Dag 1 van de volgende cyclus.
Bij graad 2 of 3 huidtoxiciteit, graad 3 diarree of graad 3 mucositis moet de behandeling worden onderbroken totdat de toxiciteit verbetert tot ≤ graad 1, waarna de behandeling wordt hervat volgens de richtlijnen in Tabel 5. Bij ≥ graad 3 perifere neuropathie moet de behandeling worden uitgesteld tot een verbetering naar ≤ graad 1. De behandeling kan worden hervat op het eerstvolgende lagere dosisniveau in de daaropvolgende cycli volgens de richtlijnen in Tabel 5. Bij alle andere gevallen van graad 3 of 4 niet‑hematologische toxiciteit moet de behandeling worden onderbroken, totdat de toxiciteit verbetert tot ≤ graad 2, waarna de behandeling wordt hervat volgens de richtlijnen in Tabel 5.
Tabel 5: Dosisverlagingen voor niet‑hematologische toxiciteit bij patiënten met niet‑kleincellige longkanker
Niet‑hematologische toxiciteit | Voorval | Dosis Abraxane | Dosis carboplatine |
Graad 2 of 3 huidtoxiciteit | Eerste | 75 | 4,5 |
Tweede | 50 | 3,0 | |
Derde | Behandeling stoppen | ||
Graad 4 huidtoxiciteit, diarree of mucositis | Eerste | Behandeling stoppen | |
1 Op Dag 1 van de cyclus van 21 dagen de dosering van Abraxane en carboplatine gelijktijdig verlagen. Op Dag 8 of 15 van de cyclus van 21 dagen de Abraxane‑dosering verlagen; de carboplatine‑dosering in de volgende cyclus verlagen.
Speciale patiëntgroepen
Leverfunctiestoornis
Voor patiënten met een lichte leverfunctiestoornis (totaal bilirubine > 1 tot ≤ 1,5 x ULN en aspartaataminotransferase [ASAT] ≤ 10 x ULN) hoeft de dosering niet te worden aangepast, ongeacht de indicatie. Deze patiënten dienen met dezelfde dosering te worden behandeld als patiënten met een normale leverfunctie.
Voor patiënten met gemetastaseerde borstkanker en patiënten met niet‑kleincellige longkanker die een matige tot ernstige leverfunctiestoornis hebben (totaal bilirubine > 1,5 tot ≤ 5 x ULN en ASAT ≤ 10 x ULN), wordt een dosisverlaging van 20% aanbevolen. De verlaagde dosis kan worden verhoogd tot de dosis voor patiënten met een normale leverfunctie als de patiënt de behandeling gedurende minstens twee cycli goed verdraagt (zie rubrieken 4.4 en 5.2).
Voor patiënten met gemetastaseerd adenocarcinoom van de pancreas die een matige tot ernstige leverfunctiestoornis hebben, zijn er onvoldoende gegevens om een doseringsadvies te kunnen doen (zie rubrieken 4.4 en 5.2).
Voor patiënten met een totaal bilirubine > 5 x ULN of ASAT > 10 x ULN zijn er onvoldoende gegevens om een doseringsadvies te doen, ongeacht de indicatie (zie rubrieken 4.4 en 5.2).
Nierfunctiestoornis
Voor patiënten met een lichte tot matige nierfunctiestoornis (geschatte creatinineklaring ≥ 30 tot < 90 ml/min) hoeft de aanvangsdosis van Abraxane niet te worden aangepast. Er zijn onvoldoende gegevens beschikbaar om dosisveranderingen van Abraxane aan te bevelen bij patiënten met een ernstige nierfunctiestoornis of een terminale nieraandoening (geschatte creatinineklaring < 30 ml/min) (zie rubriek 5.2).
Ouderen
Naast die voor alle patiënten, worden geen verdere dosisverlagingen aanbevolen voor patiënten van 65 jaar en ouder.
Van de 229 patiënten in het gerandomiseerde onderzoek die Abraxane monotherapie voor borstkanker hebben gekregen, was 13% ten minste 65 jaar oud en < 2% was 75 jaar en ouder. Geen enkele toxiciteit trad duidelijk vaker op bij patiënten van ten minste 65 jaar die Abraxane hebben gekregen. Een latere analyse bij 981 patiënten die Abraxane monotherapie kregen voor gemetastaseerde borstkanker, waarvan 15% ≥ 65 jaar oud was en 2% ≥ 75 jaar oud was, vertoonde echter een hogere incidentie van bloedneus, diarree, dehydratatie, vermoeidheid en perifeer oedeem bij patiënten van ≥ 65 jaar oud.
Van de 421 patiënten met adenocarcinoom van de pancreas die Abraxane in combinatie met gemcitabine kregen in het gerandomiseerde onderzoek, was 41% 65 jaar en ouder en 10% 75 jaar en ouder. Bij patiënten van 75 jaar en ouder die Abraxane en gemcitabine kregen, was er een hogere incidentie van ernstige bijwerkingen en bijwerkingen die tot stopzetting van de behandeling leidden (zie rubriek 4.4). Patiënten met adenocarcinoom van de pancreas die 75 jaar en ouder zijn, dienen zorgvuldig te worden beoordeeld voordat behandeling wordt overwogen (zie rubriek 4.4).
Van de 514 patiënten met niet‑kleincellige longkanker in het gerandomiseerde onderzoek die Abraxane in combinatie met carboplatine toegediend kregen, was 31% 65 jaar of ouder en was 3,5% 75 jaar of ouder. Gevallen van myelosuppressie, perifere neuropathie en artralgie kwamen vaker voor bij patiënten van 65 jaar of ouder dan bij patiënten die jonger waren dan 65 jaar. Er is beperkte ervaring met het gebruik van Abraxane/carboplatine bij patiënten van 75 jaar of ouder.
Farmacokinetische/farmacodynamische modellering met behulp van gegevens van 125 patiënten met gevorderde vaste tumoren geeft aan dat patiënten van ≥ 65 jaar oud gevoeliger kunnen zijn voor de ontwikkeling van neutropenie in de eerste behandelingscyclus.
Pediatrische patiënten
De veiligheid en werkzaamheid van Abraxane bij kinderen en adolescenten in de leeftijd van 0 tot jonger dan 18 jaar zijn niet vastgesteld. De momenteel beschikbare gegevens worden beschreven in rubriek 4.8, 5.1 en 5.2, maar er kan geen doseringsadvies worden gegeven. Er is geen relevante toepassing van Abraxane bij pediatrische patiënten voor de indicatie gemetastaseerde borstkanker of adenocarcinoom van de pancreas of niet‑kleincellige longkanker.
Wijze van toediening
Gereconstitueerde Abraxane‑dispersie moet intraveneus worden toegediend via een infuusset met een 15 μm‑filter. Om toediening van de volledige dosis zeker te stellen, wordt aanbevolen de intraveneuze lijn na toediening door te spoelen met een 9 mg/ml (0,9%) natriumchloride oplossing voor injectie.
Voor instructies over reconstitutie van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Borstvoeding (zie rubriek 4.6).
Patiënten van wie op uitgangsniveau het aantal neutrofielen < 1500 cellen/mm3 is.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De vaakst voorkomende, klinisch significante bijwerkingen die in verband zijn gebracht met het gebruik van Abraxane waren neutropenie, perifere neuropathie, artralgie/myalgie en maagdarmstelselaandoeningen.
Lijst van bijwerkingen in tabelvorm
In Tabel 6 staan de bijwerkingen vermeld die in verband zijn gebracht met de toediening van Abraxane aan patiënten tijdens klinische onderzoeken waarin Abraxane is toegediend als monotherapie bij welke dosis en bij welke indicatie ook (n = 789), Abraxane in combinatie met gemcitabine voor pancreatisch adenocarcinoom uit het fase 3 klinische onderzoek (n = 421), Abraxine in combinatie met carboplatine voor niet-kleincellige longkanker uit het fase III klinische onderzoek (n = 514) en uit post-marketing-gebruik.
De frequenties zijn als volgt gedefinieerd: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000), niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen iedere frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Tabel 6: Bijwerkingen gemeld met Abraxane
| Monotherapie (n = 789) | Combinatietherapie met gemcitabine | Combinatietherapie met carboplatine |
Infecties en parasitaire aandoeningen | |||
Vaak: | Infectie, urineweginfectie, folliculitis, bovensteluchtweginfectie, candidiasis, sinusitis | Sepsis, pneumonie, orale candidiasis | Pneumonie, bronchitis, bovensteluchtweginfectie, urineweginfectie |
Soms: | Sepsis1, neutropenische sepsis1, pneumonie, orale candidiasis, nasofaryngitis, cellulitis, herpes simplex, virusinfectie, herpes zoster, schimmelinfectie, kathetergerelateerde infectie, infectie op de injectieplaats |
| Sepsis, orale candidiasis |
Neoplasmata, benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) | |||
Soms: | Tumornecrose, metastatische pijn |
|
|
Bloed- en lymfestelselaandoeningen | |||
Zeer vaak: | Beenmergsuppressie, neutropenie, trombocytopenie, anemie, leukopenie, lymfopenie | Neutropenie, trombocytopenie, anemie | Neutropenie3, thrombocytopenie3, anemie3, leukopenie3 |
Vaak: | Febriele neutropenie | Pancytopenie | Febriele neutropenie, lymfopenie |
Soms: |
| Trombotische trombocytopenische purpura | Pancytopenie |
Zelden: | Pancytopenie |
|
|
Immuunsysteemaandoeningen | |||
Soms: | Overgevoeligheid |
| Overgevoeligheid voor het geneesmiddel, overgevoeligheid |
Zelden: | Ernstige overgevoeligheid1 |
|
|
Voedings- en stofwisselingsstoornissen | |||
Zeer vaak: | Anorexia | Dehydratatie, verminderde eetlust, hypokaliëmie | Verminderde eetlust |
Vaak: | Dehydratatie, verminderde eetlust, hypokaliëmie |
| Dehydratatie |
Soms: | Hypofosfatemie, vochtophoping, hypoalbuminemie, polydipsie, hyperglykemie, hypercalciëmie, hypoglykemie, hyponatriëmie |
|
|
Niet bekend: | Tumorlysesyndroom1 |
|
|
Psychische stoornissen | |||
Zeer vaak: |
| Depressie, slapeloosheid |
|
Common: | Depressie, slapeloosheid, angst | Angst | Slapeloosheid |
Soms: | Rusteloosheid |
|
|
Zenuwstelselaandoeningen | |||
Zeer vaak: | Perifere neuropathie, neuropathie, hypo-esthesie, paresthesie | Perifere neuropathie, duizeligheid, hoofdpijn, dysgeusie | Perifere neuropathie |
Vaak: | Perifere sensorische neuropathie, duizeligheid, perifere motorneuropathie, ataxie, hoofdpijn, sensorische stoornis, slaperigheid, dysgeusie |
| Duizeligheid, hoofdpijn dysgeusie |
Soms: | Polyneuropathie, areflexie, syncope, posturale duizeligheid, dyskinesie, hyporeflexie, neuralgie, neuropathische pijn, tremor, gevoelsverlies | Verlamming VIIe hersenzenuw |
|
Niet bekend: | Hersenzenuwverlammingen meerdere1 |
|
|
Oogaandoeningen | |||
Vaak: | Wazig zicht, toegenomen traanproductie, droge ogen, keratoconjunctivitis sicca, madarose | Toegenomen traanproductie | Wazig zicht |
Soms: | Verminderde gezichtsscherpte, abnormaal zicht, oogirritatie, oogpijn, conjunctivitis, gezichtsstoornis, jeukende ogen, keratitis | Cystoïde maculair oedeem |
|
Zelden: | Cystoïde maculair oedeem1 |
|
|
Evenwichtsorgaan- en ooraandoeningen | |||
Vaak: | Vertigo |
|
|
Soms: | Tinnitus, oorpijn |
|
|
Hartaandoeningen | |||
Vaak: | Aritmie, tachycardie, supraventriculaire tachycardie | Congestief hartfalen, tachycardie |
|
Zelden: | Hartstilstand, congestief hartfalen, linkerventrikeldysfunctie, atrioventriculair blok1, bradycardie |
|
|
Bloedvataandoeningen | |||
Vaak: | Hypertensie, lymfoedeem, blozen, opvliegers | Hypotensie, hypertensie | Hypotensie, hypertensie |
Soms: | Hypotensie, orthostatische hypotensie, perifere koudheid | Blozen | Blozen |
Zelden: | Trombose |
|
|
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | |||
Zeer vaak: |
| Dyspnoe, epistaxis, hoesten | Dyspnoe |
Vaak: | Interstitiële pneumonitis2, dyspnoe, epistaxis, faryngolaryngeale pijn, hoesten, rinitis, postnasale drip | Pneumonitis, verstopte neus | Hemoptyse, epistaxis, hoesten |
Soms: | Pulmonaire embolie, pulmonaire trombo‑embolie, pleurale effusie, inspanningsdyspneu, verstopte neus, verminderd ademhalingsgeluid, productieve hoest, allergische rinitis, heesheid, verstopte neus, droge neus, piepende ademhaling | Droge keel, droge neus | Pneumonitis |
Niet bekend: | Stembandparese1 |
|
|
Maagdarmstelselaandoeningen | |||
Zeer vaak: | Diarree, braken, misselijkheid verstopping, stomatitis | Diarree, braken, misselijkheid, verstopping, buikpijn, pijn in de bovenbuik | Diarree, braken, misselijkheid, verstopping |
Vaak: | Gastro-oesofageale refluxziekte, dyspepsie, buikpijn, opgeblazen buik, pijn in de bovenbuik, orale hypo‑esthesie | Darmobstructie, colitis, stomatitis, droge mond | Stomatitis, dyspepsie, dysfagie, buikpijn |
Soms: | Rectale bloeding, dysfagie, winderigheid, glossodynie, droge mond, tandvleespijn, dunne ontlasting, oesofagitis, pijn in de onderbuik, mondzweren, orale pijn |
|
|
Lever- en galaandoeningen | |||
Vaak: |
| Cholangitis | Hyperbilirubinemie |
Soms: | Hepatomegalie |
|
|
Huid- en onderhuidaandoeningen | |||
Zeer vaak: | Alopecia, uitslag | Alopecia, uitslag | Alopecia, uitslag |
Vaak: | Pruritus, droge huid, nagelaandoening, erytheem, nagelpigmentatie/-verkleuring, hyperpigmentatie van de huid, onycholyse, nagelveranderingen | Pruritus, droge huid, nagelaandoening | Pruritus, nagelaandoening |
Soms: | Lichtgevoeligheidsreactie, urticaria, huidpijn, gegeneraliseerde pruritus, jeukende uitslag, huidaandoening, pigmentatie-aandoening, hyperhidrose, onychomadese, erythemateuze uitslag, gegeneraliseerde uitslag, dermatitis, nachtelijk zweten, maculo‑papulaire uitslag, vitiligo, hypotrichose, gevoeligheid van het nagelbed, nagelongemak, maculaire uitslag, papulaire uitslag, huidlaesie, opgezwollen gezicht |
| Huidafschilfering, contactdermatitis, urticaria |
Zeer zelden: | Stevens‑Johnson‑syndroom1, toxische epidermale necrolyse1 |
|
|
Niet bekend: | Palmoplantair erytrodysesthesie syndroom1, 4, scleroderma1 |
|
|
Skeletspierstelsel- en bindweefselaandoeningen | |||
Zeer vaak: | Artralgie, myalgie | Artralgie, myalgie, pijn in de ledematen | Artralgie, myalgie |
Vaak: | Rugpijn, pijn in de ledematen, botpijn, spierkrampen, ledemaatpijn | Spierzwakte, botpijn | Rugpijn, pijn in de ledematen, musculoskeletale pijn |
Soms: | Borstkaspijn, spierzwakte, nekpijn, liespijn, spierspasmen, musculoskeletale pijn, pijn in de zij, ongemak in de ledematen, spierzwakte |
|
|
Nier- en urinewegaandoeningen | |||
Vaak: |
| Acute nierinsufficiëntie |
|
Soms: | Hematurie, dysurie, pollakiurie, nocturie, polyurie, urine‑incontinentie | Hemolytisch uremisch syndroom |
|
Zwangerschap, perinatale periode en puerperium | |||
Soms: | Borstpijn |
|
|
Algemene aandoeningen en toedieningsplaatsstoornissen | |||
Zeer vaak: | Vermoeidheid, asthenie, pyrexie | Vermoeidheid, asthenie, pyrexie, perifeer oedeem, rillingen | Vermoeidheid, asthenie, perifeer oedeem |
Vaak: | Malaise, lethargie, zwakte, perifeer oedeem, slijmvliesontsteking, pijn, rillingen, oedeem, afgenomen prestatiestatus, pijn in borstkas, griepachtige ziekte, hyperpyrexie | Reactie op de infusieplaats | Pyrexie, pijn in de borstkas |
Soms: | Ongemak op de borst, afwijkende loopgang, zwelling, reactie op de infusieplaats |
| Slijmvliesontsteking, extravasatie op de infusieplaats, ontsteking van de infusieplaats, uitslag op de infusieplaats |
Zelden: | Extravasatie |
|
|
Onderzoeken | |||
Zeer vaak: |
| Gewichtsafname, toegenomen alanine-aminotransferase |
|
Vaak: | Gewichtsafname, toegenomen alanine-aminotransferase, toegenomen aspartaat-aminotransferase, afgenomen hematocriet, afgenomen aantal rode bloedcellen, hogere lichaamstemperatuur, toegenomen gamma‑glutamyltransferase, toegenomen alkalinefosfatase in het bloed | Toegenomen aspartaat -aminotransferase, toegenomen bilirubine in het bloed, toegenomen creatinine in het bloed | Gewichtsafname, toegenomen alanine-aminotransferase, toegenomen aspartaat aminotransferase, toegenomen alkaline fosfatase in het bloed |
Soms: | Hogere bloeddruk, gewichtstoename, toegenomen lactaatdehydrogenase in het bloed, toegenomen creatinine in het bloed, toegenomen bloedglucose, toegenomen fosfor in het bloed, afgenomen kalium in het bloed, toegenomen bilirubine |
|
|
Letsels, intoxicaties en verrichtingscomplicaties | |||
Soms: | Contusie |
|
|
Zelden: | Radiatie-recallfenomeen, bestralingspneumonitis |
|
|
1 Zoals gerapporteerd in de postmarketingsurveillance van Abraxane.
2 De frequentie van pneumonitis is berekend op basis van gepoolde gegevens bij 1310 patiënten die in klinisch onderzoek Abraxane monotherapie kregen voor borstkanker en voor andere indicaties.
3 Op basis van laboratoriumbeoordelingen: maximale mate van myelosuppressie (behandelde populatie).
4 Bij sommige patiënten eerder blootgesteld aan capecitabine.
Beschrijving van geselecteerde bijwerkingen
Dit deel bevat de vaakst voorkomende en klinisch relevante bijwerkingen bij Abraxane.
Bijwerkingen werden beoordeeld bij 229 patiënten met gemetastaseerde borstkanker die behandeld werden met 260 mg/m2 Abraxane om de drie weken in het belangrijkste fase 3‑, klinisch onderzoek (Abraxane monotherapie).
Bijwerkingen werden beoordeeld bij 421 patiënten met gemetastaseerde pancreaskanker die Abraxane in combinatie met gemcitabine kregen (125 mg/m2 Abraxane in combinatie met gemcitabine met een dosis van 1000 mg/m2 gegeven op Dag 1, 8 en 15 van elke cyclus van 28 dagen) en 402 patiënten die gemcitabine monotherapie kregen als systemische eerstelijnsbehandeling voor gemetastaseerd adenocarcinoom van de pancreas (Abraxane/gemcitabine).
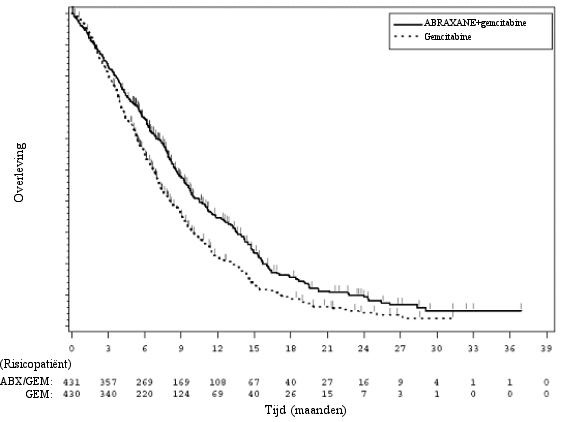
Bijwerkingen werden beoordeeld bij 514 patiënten met niet-kleincellige longkanker behandeld met Abraxane in combinatie met carboplatine (100 mg/m2 Abraxane gegeven op Dag 1, 8 en 15 van elke cyclus van 21 dagen in combinatie met carboplatine gegeven op Dag 1 van iedere cyclus) in het fase 3 gerandomiseerd, gecontroleerd klinisch onderzoek (Abraxane/carboplatine). De door patiënten gemelde taxaantoxiciteit werd beoordeeld op basis van de 4 subschalen van de Functional Assessment of Cancer Therapy (FACT)‑Taxaan vragenlijst. Op basis van een analyse van herhaalde metingen waren 3 van de 4 subschalen (perifere neuropathie, pijn in handen/voeten, en gehoor) ten gunste van Abraxane en carboplatine (p ≤ 0,002). Voor de andere subschaal (oedeem) was er geen verschil tussen de behandelingsgroepen
Infecties en parasitaire aandoeningen
Abraxane/gemcitabine
Sepsis is gemeld bij 5% van de patiënten met of zonder neutropenie die Abraxane in combinatie met gemcitabine kregen tijdens een onderzoek naar adenocarcinoom van de pancreas. Van de 22 meldingen van sepsis bij patiënten behandeld met Abraxane in combinatie met gemcitabine was de uitkomst bij 5 fataal. Complicaties als gevolg van de onderliggende pancreaskanker, met name galwegobstructie of de aanwezigheid van een galwegstent, werden als significant bijdragende factoren beschouwd. Als een patiënt koorts ontwikkelt (ongeacht de neutrofielentelling) dient behandeling met breedspectrumantibiotica te worden ingesteld. Bij febriele neutropenie dienen Abraxane en gemcitabine niet te worden toegediend totdat de koorts is verdwenen en ANC ≥ 1500 cellen/mm3; de behandeling dient vervolgens te worden hervat met een lager dosisniveau (zie rubriek 4.2).
Bloed- en lymfestelselaandoeningen
Abraxane monotherapie‑gemetastaseerde borstkanker
Bij patiënten met gemetastaseerde borstkanker was neutropenie de meest opvallende hematologische toxiciteit (gemeld bij 79% van de patiënten) en was snel omkeerbaar en dosisafhankelijk; leukopenie werd gemeld bij 71% van de patiënten. Graad 4 neutropenie (< 500 cellen/mm3) trad op bij 9% van de met Abraxane behandelde patiënten. Febriele neutropenie trad op bij vier patiënten die met Abraxane behandeld zijn. Anemie (Hb < 10 g/dl) werd waargenomen bij 46% van de patiënten die met Abraxane behandeld werden en was in drie gevallen ernstig (Hb < 8 g/dl). Lymfopenie werd waargenomen bij 45% van de patiënten.
Abraxane/gemcitabine
Tabel 7 geeft de frequentie en ernst van hematologische afwijkingen gedetecteerd via laboratoriumonderzoek weer voor patiënten die behandeld werden met Abraxane in combinatie met gemcitabine of met gemcitabine alleen.
Tabel 7: Hematologische afwijkingen gedetecteerd via laboratoriumonderzoek in een onderzoek naar adenocarcinoom van de pancreas
| Abraxane (125 mg/m2)/ gemcitabine | Gemcitabine | ||
Graad 1‑4 | Graad 3‑4 | Graad 1‑4 | Graad 3‑4 | |
Anemiea,b | 97 | 13 | 96 | 12 |
Neutropeniea,b | 73 | 38 | 58 | 27 |
Trombocytopenieb,c | 74 | 13 | 70 | 9 |
a 405 patiënten beoordeeld in de groep behandeld met Abraxane/gemcitabine
b 388 patiënten beoordeeld in de groep behandeld met gemcitabine
c 404 patiënten beoordeeld in de groep behandeld met Abraxane/gemcitabine
Abraxane/carboplatine
Anemie en trombocytopenie werden vaker gemeld in de behandelingsgroep met Abraxane dan in de behandelingsgroep met Taxol en carboplatine (respectievelijk 54% versus 28% en 45% versus 27%).
Zenuwstelselaandoeningen
Abraxane monotherapie-gemetastaseerde borstkanker
In het algemeen was de frequentie en ernst van neurotoxiciteit dosisafhankelijk bij patiënten die Abraxane kregen. Perifere neuropathie (voor het grootste deel graad 1 of 2 sensorische neuropathie) werd waargenomen bij 68% van de patiënten die Abraxane kregen, waarbij 10% graad 3 was en er geen gevallen van graad 4 waren.
Abraxane/gemcitabine
Voor patiënten behandeld met Abraxane in combinatie met gemcitabine bedroeg de mediane tijd tot het eerste optreden van graad 3 perifere neuropathie 140 dagen. De mediane tijd tot verbetering met minstens 1 graad bedroeg 21 dagen en de mediane tijd tot verbetering van graad 3 perifere neuropathie tot graad 0 of 1 bedroeg 29 dagen. Van de patiënten bij wie de behandeling werd onderbroken wegens perifere neuropathie kon 44% (31/70 patiënten) de behandeling met Abraxane hervatten met een lagere dosis. Geen van de patiënten die met Abraxane in combinatie met gemcitabine behandeld werden, ontwikkelde graad 4 perifere neuropathie.
Abraxane/carboplatine
Voor patiënten met niet‑kleincellige longkanker die met Abraxane en carboplatine behandeld werden, bedroeg de mediane tijd tot het eerste optreden van graad 3 behandelingsgerelateerde perifere neuropathie 121 dagen en bedroeg de mediane tijd tot verbetering van graad 3 behandelingsgerelateerde perifere neuropathie tot graad 1 38 dagen. Geen van de patiënten die met Abraxane en carboplatine werden behandeld, ontwikkelde graad 4 perifere neuropathie.
Oogaandoeningen
Er zijn zeldzame meldingen geweest tijdens postmarketingsurveillance van verminderde gezichtsscherpte als gevolg van cystoïde maculaoedeem tijdens behandeling met Abraxane (zie rubriek 4.4).
Ademhalingsstelsel, borstkas en mediastinumaandoeningen
Abraxane/gemcitabine
Pneumonitis is gemeld bij 4% van de patiënten wanneer Abraxane in combinatie met gemcitabine werd gebruikt. Van de 17 gevallen van pneumonitis gemeld bij patiënten die behandeld werden met Abraxane in combinatie met gemcitabine, hadden 2 gevallen een fatale afloop. Patiënten dienen nauwgezet te worden gecontroleerd op klachten en verschijnselen van pneumonitis. Na uitsluiting van infectieuze etiologie en diagnose van pneumonitis moet de behandeling met Abraxane en gemcitabine permanent worden stopgezet en dient onmiddellijk gestart te worden met een geschikte behandeling en ondersteunende maatregelen (zie rubriek 4.2).
Maagdarmstelselaandoeningen
Abraxane monotherapie‑gemetastaseerde borstkanker
Misselijkheid trad op bij 29% van de patiënten en diarree bij 25% van de patiënten.
Huid- en onderhuidaandoeningen
Abraxane monotherapie‑gemetastaseerde borstkanker
Alopecia werd waargenomen bij > 80% van de met Abraxane behandelde patiënten. De meeste gevallen van alopecia traden minder dan een maand na aanvang van de behandeling met Abraxane op. Bij de meeste patiënten die alopecia ontwikkelen, is ernstige haaruitval van ≥ 50% te verwachten.
Skeletspierstelsel- en bindweefselaandoeningen
Abraxane monotherapie‑gemetastaseerde borstkanker
Artralgie trad op bij 32% van de patiënten die Abraxane kregen en was in 6% van de gevallen ernstig. Myalgie trad op bij 24% van de patiënten die Abraxane kregen en was in 7% van de gevallen ernstig. De symptomen waren gewoonlijk van voorbijgaande aard, traden gewoonlijk drie dagen na de toediening van Abraxane op en waren binnen een week verdwenen.
Algemene aandoeningen en toedieningsplaatsstoornissen
Abraxane monotherapie‑gemetastaseerde borstkanker
Asthenie/vermoeidheid werd gemeld bij 40% van de patiënten.
Pediatrische patiënten
Het onderzoek bestond uit 106 patiënten, van wie 104 pediatrische patiënten in de leeftijd van 6 maanden tot jonger dan 18 jaar (zie rubriek 5.1). Elke patiënt ondervond minstens 1 bijwerking. De meest frequent gemelde bijwerkingen waren neutropenie, anemie, leukopenie en pyrexie. Ernstige bijwerkingen gemeld bij meer dan 2 patiënten waren pyrexie, rugpijn, perifeer oedeem en braken. Er werden geen nieuwe veiligheidssignalen geïdentificeerd bij het beperkte aantal pediatrische patiënten behandeld met Abraxane en het veiligheidsprofiel was vergelijkbaar met dat van de volwassen populatie.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico's van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem zoals vermeld in aanhangsel V.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Bristol‑Myers Squibb Pharma EEIG
Plaza 254
Blanchardstown Corporate Park 2
Dublin 15, D15 T867
Ierland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/07/428/001
EU/1/07/428/002
10. DATUM VAN HERZIENING VAN DE TEKST
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2834786 | ABRAXANE 5 MG/ML 100 MG PDR SUSP INFUSIE FL 1 | L01CD01 | - | € 190,91 | Ja | - | - |