1. DÉNOMINATION DU MÉDICAMENT
Abraxane 5 mg/mL poudre pour dispersion injectable pour perfusion.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient 100 mg de paclitaxel dans une formulation de nanoparticules liées à l’albumine.
Chaque flacon contient 250 mg de paclitaxel dans une formulation de nanoparticules liées à l’albumine.
Après reconstitution, chaque mL de dispersion contient 5 mg de paclitaxel dans une formulation de nanoparticules liées à l’albumine.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour dispersion injectable pour perfusion.
La dispersion reconstituée a un pH compris entre 6 et 7,5 et une osmolalité de 300 à 360 mOsm/kg.
La poudre est de couleur blanche tirant sur le jaune.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Abraxane est indiqué en monothérapie dans le traitement du cancer du sein métastatique, chez les patients adultes en échec du traitement de première ligne du cancer métastasé, et pour qui le traitement standard incluant une anthracycline n’est pas indiqué (voir rubrique 4.4).
Abraxane en association avec la gemcitabine est indiqué dans le traitement de première ligne de l’adénocarcinome du pancréas métastatique chez les patients adultes.
Abraxane en association avec le carboplatine est indiqué dans le traitement de première ligne du cancer bronchique non à petites cellules chez les patients adultes qui ne sont pas candidats à une chirurgie potentiellement curative et/ou une radiothérapie.
4.2 Posologie et mode d’administration
Abraxane ne doit être administré que sous la responsabilité d’un oncologue qualifié au sein d’une unité spécialisée dans l’administration d’agents cytotoxiques. Il ne doit ni remplacer ni être substitué par d’autres formulations de paclitaxel.
Posologie
Cancer du sein
La dose recommandée d’Abraxane est de 260 mg/m2 administrée en perfusion intraveineuse de 30 minutes toutes les 3 semaines.
Adaptations de la dose au cours du traitement du cancer du sein
Les patients présentant une neutropénie sévère (taux de neutrophiles < 500/mm3 pendant au moins une semaine) ou d’une neuropathie sensitive sévère au cours du traitement par Abraxane devront recevoir une dose réduite à 220 mg/m2 pour la suite du traitement. Suite à la récidive d’une neutropénie sévère ou d’une neuropathie sensitive sévère, la dose sera à nouveau réduite à 180 mg/m2. Abraxane ne doit pas être administré avant que le taux de neutrophiles ne redevienne > 1 500/mm3. Pour les neuropathies sensitives de grade 3, le traitement sera suspendu jusqu’à ce que la neuropathie régresse au grade 1 ou 2, et la dose administrée sera réduite pour l’ensemble des cures suivantes.
Adénocarcinome du pancréas
La dose recommandée d’Abraxane en association avec la gemcitabine est de 125 mg/m2 administrée en perfusion intraveineuse de 30 minutes les jours 1, 8 et 15 de chaque cycle de 28 jours. La dose concomitante recommandée de gemcitabine est de 1 000 mg/m2 administrée en perfusion intraveineuse de 30 minutes immédiatement après la fin de l’administration d’Abraxane les jours 1, 8 et 15 de chaque cycle de 28 jours.
Adaptations de la dose au cours du traitement de l’adénocarcinome du pancréas
Tableau 1 : Réductions de doses chez les patients présentant un adénocarcinome du pancréas
Palier de dose | Dose d’Abraxane (mg/m2) | Dose de gemcitabine (mg/m2) |
Pleine dose | 125 | 1 000 |
1re réduction de dose | 100 | 800 |
2e réduction de dose | 75 | 600 |
Si une réduction supplémentaire de la dose est nécessaire | Arrêter le traitement | Arrêter le traitement |
Tableau 2 : Modifications de doses en cas de neutropénie et/ou de thrombopénie au début d’un cycle ou pendant un cycle chez les patients présentant un adénocarcinome du pancréas
Jour du cycle | Taux de PNN (cellules/mm3) |
| Taux de plaquettes (cellules/mm3) | Dose d’Abraxane | Dose de gemcitabine |
Jour 1 | < 1 500 | OU | < 100 000 | Différer le traitement jusqu’à la récupération | |
Jour 8 | ≥ 500 mais < 1 000 | OU | ≥ 50 000 mais < 75 000 | Réduire les doses d’un palier | |
| < 500 | OU | < 50 000 | Interrompre le traitement | |
Jour 15 : Si les doses du jour 8 ont été administrées sans modification : | |||||
Jour 15 | ≥ 500 mais < 1 000 | OU | ≥ 50 000 mais < 75 000 | Traiter aux doses du jour 8 puis administrer des facteurs de croissance leucocytaire | |
| < 500 | OU | < 50 000 | Interrompre le traitement | |
Jour 15 : Si les doses du jour 8 ont été réduites : | |||||
Jour 15 | ≥ 1 000 | ET | ≥ 75 000 | Revenir aux doses du jour 1 puis administrer des facteurs de croissance leucocytaire | |
| ≥ 500 mais < 1 000 | OU | ≥ 50 000 mais < 75 000 | Traiter aux doses du jour 8 puis administrer des facteurs de croissance leucocytaire | |
| < 500 | OU | < 50 000 | Interrompre le traitement | |
Jour 15 : Si l’administration du traitement a été suspendue le jour 8 : | |||||
Jour 15 | ≥ 1 000 | ET | ≥ 75 000 | Revenir aux doses du jour 1 puis administrer des facteurs de croissance leucocytaire | |
| ≥ 500 mais < 1 000 | OU | ≥ 50 000 mais < 75 000 | Réduire d’un palier de dose puis administrer des facteurs de croissance leucocytaire | |
| < 500 | OU | < 50 000 | Interrompre le traitement | |
Abréviation : PNN = polynucléaires neutrophiles
Tableau 3 : Modifications de doses en cas d’autres effets indésirables chez les patients présentant un adénocarcinome du pancréas
Effet indésirable (EI) | Dose d’Abraxane | Dose de gemcitabine |
Neutropénie fébrile : | Interrompre le traitement jusqu’à résolution de la fièvre et taux de PNN ≥ 1 500 ; reprendre le traitement au palier de dose immédiatement inférieura | |
Neuropathie périphérique : | Interrompre le traitement jusqu’à régression au grade ≤ 1 ; | Traiter à la même dose |
Toxicité cutanée : | Diminuer au palier de dose immédiatement inférieura ; | |
Toxicité gastro‑intestinale : | Interrompre le traitement jusqu’à régression au grade ≤ 1 ; | |
a Voir le tableau 1 pour les réductions de doses.
Cancer bronchique non à petites cellules
La dose recommandée d’Abraxane est de 100 mg/m2 administrée en perfusion intraveineuse de 30 minutes les jours 1, 8 et 15 de chaque cycle de 21 jours. La dose recommandée de carboplatine est AUC = 6 mg•min/mL, seulement le jour 1 de chaque cycle de 21 jours, immédiatement après la fin de l’administration d’Abraxane.
Adaptations de la dose au cours du traitement du cancer bronchique non à petites cellules
Abraxane ne doit être administré le jour 1 d’un cycle que si le taux de polynucléaires neutrophiles (PNN) est ≥ 1 500 /mm3 et le taux de plaquettes ≥ 100 000 /mm3. Pour chaque administration hebdomadaire ultérieure d’Abraxane, les patients doivent avoir un taux de PNN ≥ 500 /mm3 et un taux de plaquettes > 50 000 /mm3 sinon le traitement doit être suspendu jusqu’à la récupération. Après récupération des taux, reprendre le traitement la semaine suivante conformément aux critères présentés dans le tableau 4. La dose suivante ne doit être réduite que si les critères présentés dans le tableau 4 sont remplis.
Tableau 4 : Réductions de dose en cas de toxicités hématologiques chez les patients présentant un cancer bronchique non à petites cellules
Toxicité hématologique | Survenue | Dose d’Abraxane | Dose de carboplatine |
Nadir des PNN < 500/mm3 avec fièvre neutropénique > 38 °C
Report du prochain cycle en raison d’une neutropénie persistante2 (Nadir des PNN < 1 500/mm3)
Nadir des PNN < 500/mm3 pendant > 1 semaine | Première | 75 | 4,5 |
Deuxième | 50 | 3,0 | |
Troisième | Arrêter le traitement | ||
Nadir des plaquettes < 50 000/mm3 | Première | 75 | 4.5 |
Deuxième | Arrêter le traitement | ||
1 Le jour 1 du cycle de 21 jours, réduire simultanément les doses d’Abraxane et de carboplatine. Le jour 8 ou le jour 15 du cycle de 21 jours, réduire la dose d’Abraxane ; réduire la dose de carboplatine lors du cycle suivant.
2 Pendant 7 jours au maximum après la dose programmée du jour 1 du prochain cycle.
En cas de toxicité cutanée de grade 2 ou 3, de diarrhée de grade 3 ou de mucite de grade 3, interrompre le traitement jusqu’à la régression de la toxicité à un grade ≤ 1, puis reprendre le traitement conformément aux recommandations figurant dans le tableau 5. En cas de neuropathie périphérique de grade ≥ 3, interrompre le traitement jusqu’à la régression de la neuropathie à un grade ≤ 1. Le traitement pourra être repris au palier de dose immédiatement inférieur lors des cycles suivants, conformément aux recommandations figurant dans le tableau 5. Pour toute autre toxicité non hématologique de grade 3 ou 4, interrompre le traitement jusqu’à la régression de la toxicité à un grade ≤ 2, puis reprendre le traitement conformément aux recommandations figurant dans le tableau 5.
Tableau 5 : Réductions de dose en cas de toxicités non hématologiques chez les patients présentant un cancer bronchique non à petites cellules
Toxicité non hématologique | Survenue | Dose d’Abraxane | Dose de carboplatine |
Toxicité cutanée de grade 2 ou 3 | Première | 75 | 4,5 |
Deuxième | 50 | 3,0 | |
Troisième | Arrêter le traitement | ||
Toxicité cutanée, diarrhée ou mucite de grade 4 | Première | Arrêter le traitement | |
1 Le jour 1 du cycle de 21 jours, réduire simultanément les doses d’Abraxane et de carboplatine. Le jour 8 ou le jour 15 du cycle de 21 jours, réduire la dose d’Abraxane ; réduire la dose de carboplatine lors du cycle suivant.
Populations particulières
Insuffisance hépatique
Aucune adaptation de la dose n’est nécessaire chez les patients présentant une insuffisance hépatique légère (bilirubine totale > 1 et ≤ 1,5 x LNS et aspartate aminotransférase ASAT ≤ 10 x LNS), quelle que soit l’indication. Ces patients doivent être traités aux mêmes doses que ceux ayant une fonction hépatique normale.
Chez les patients présentant un cancer du sein métastatique ou un cancer bronchique non à petites cellules atteints d’insuffisance hépatique modérée à sévère (bilirubine totale > 1,5 et ≤ 5 x LNS et ASAT ≤ 10 x LNS), une réduction de 20 % de la dose est recommandée. La dose réduite pourra être augmentée à la dose utilisée chez les patients ayant une fonction hépatique normale si le patient tolère le traitement pendant au moins deux cycles (voir rubriques 4.4 et 5.2).
Chez les patients présentant un adénocarcinome du pancréas métastatique atteints d’insuffisance hépatique modérée à sévère, les données sont insuffisantes pour permettre des recommandations posologiques (voir rubriques 4.4 et 5.2).
Chez les patients ayant un taux de bilirubine totale > 5 x LNS ou d’ASAT > 10 x LNS, les données sont insuffisantes pour permettre des recommandations posologiques, quelle que soit l’indication (voir rubriques 4.4 et 5.2).
Insuffisance rénale
Il n’est pas nécessaire d’adapter la dose initiale d’Abraxane chez les patients présentant une insuffisance rénale légère à modérée (clairance de la créatinine estimée ≥ 30 et < 90 mL/min). Il n’existe pas de données suffisantes pour recommander une adaptation de la dose d’Abraxane chez les patients atteints d’insuffisance rénale sévère ou terminale (clairance de la créatinine estimée < 30 mL/min) (voir rubrique 5.2).
Sujets âgés
Aucune réduction de dose supplémentaire, autre que les réductions indiquées pour tous les patients, n’est recommandée chez les patients âgés de 65 ans et plus.
Chez les 229 patients ayant reçu Abraxane en monothérapie dans le traitement d’un cancer du sein dans l’étude randomisée, 13 % étaient âgés d’au moins 65 ans et < 2 % étaient âgés de 75 ans et plus. Aucune toxicité n’a été observée plus fréquemment chez les patients âgées d’au moins 65 ans ayant reçu Abraxane. Cependant, une analyse ultérieure portant sur 981 patients recevant Abraxane en monothérapie pour un cancer du sein métastatique, dont 15 % étaient âgés de ≥ 65 ans et 2 % de ≥ 75 ans, a montré une incidence plus élevée d’épistaxis, de diarrhée, de déshydratation, de fatigue et d’œdème périphérique chez les patients âgés de ≥ 65 ans.
Chez les 421 patients atteints d’un adénocarcinome du pancréas ayant reçu Abraxane en association avec la gemcitabine dans l’étude randomisée, 41 % étaient âgés de 65 ans et plus et 10 % étaient âgés de 75 ans et plus. Chez les patients âgés de 75 ans et plus ayant reçu Abraxane et la gemcitabine, il a été observé une incidence plus élevée d’effets indésirables graves et d’effets indésirables ayant entraîné l’arrêt du traitement (voir rubrique 4.4). Les patients atteints d’un adénocarcinome du pancréas âgés de 75 ans et plus doivent être évalués soigneusement avant d’envisager le traitement (voir rubrique 4.4).
Chez les 514 patients présentant un cancer bronchique non à petites cellules ayant reçu Abraxane en association avec le carboplatine dans l’étude randomisée, 31 % étaient âgés de 65 ans et plus et 3,5 % étaient âgés de 75 ans et plus. Les événements d’aplasie médullaire, de neuropathie périphérique et les arthralgies ont été plus fréquents chez les patients âgés de 65 ans et plus que chez les patients de moins de 65 ans. Les données sur l’utilisation d’Abraxane en association avec le carboplatine chez les patients âgés de 75 ans et plus sont limitées.
Une modélisation pharmacocinétique/pharmacodynamique utilisant les données de 125 patients présentant des tumeurs solides avancées indiquent que les patients âgés de ≥ 65 ans peuvent être plus susceptibles de développer une neutropénie pendant le premier cycle de traitement.
Population pédiatrique
La sécurité et l’efficacité d’Abraxane chez les enfants et adolescents âgés de 0 à moins de 18 ans n’ont pas été établies. Les données actuellement disponibles sont décrites aux rubriques 4.8, 5.1 et 5.2 mais aucune recommandation sur la posologie ne peut être donnée. Il n’existe pas d’utilisation justifiée d’Abraxane dans la population pédiatrique pour l’indication du cancer du sein métastatique, de l’adénocarcinome du pancréas métastatique ou du cancer bronchique non à petites cellules.
Mode d’administration
Administrer la dispersion reconstituée d’Abraxane par voie intraveineuse, à l’aide d’un set de perfusion muni d’un filtre de 15 μm. Après l’administration d’Abraxane, il est recommandé de rincer la tubulure avec une solution injectable de chlorure de sodium à 0,9 % (9 mg/mL) afin de garantir l’administration de la dose complète.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
4.3 Contre‑indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Allaitement (voir la rubrique 4.6).
Patients dont le taux de neutrophiles avant traitement est < 1 500/mm3.
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables cliniquement significatifs les plus fréquents associés à Abraxane ont été une neutropénie, une neuropathie périphérique, des arthralgies/myalgies et des affections gastro‑intestinales.
Liste tabulée des effets indésirables
Le tableau 6 dresse la liste des effets indésirables associés à Abraxane en monothérapie, toutes doses et indications confondues pendant des essais cliniques (N = 789), à Abraxane en association avec la gemcitabine pour le traitement de l’adénocarcinome pancréatique dans un essai clinique de phase III (N = 421), à Abraxane en association avec le carboplatine pour le traitement du cancer bronchique non à petites cellules dans un essai clinique de phase III (N = 514) et en utilisation post‑commercialisation.
Les fréquences sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 6 : Effets indésirables signalés avec Abraxane
| Monothérapie (N = 789) | Association à la gemcitabine | Association au carboplatine |
Infections et infestations | |||
Fréquent : | Infection, infection des voies urinaires, folliculite, infection des voies aériennes supérieures, candidiase, sinusite | Sepsis, pneumonie, candidose orale | Pneumonie, bronchite, infection des voies aériennes supérieures, infection des voies urinaires |
Peu fréquent : | Sepsis1, sepsis neutropénique1, candidose orale, rhinopharyngite, cellulite, herpès, infection virale, zona, infection fongique, infection liée au cathéter, infection au site d’injection, |
| Sepsis, candidose orale |
Tumeurs bénignes, malignes et non précisées (inclus kystes et polypes) | |||
Peu fréquent : | Nécrose de la tumeur, douleur métastatique, |
|
|
Affections hématologiques et du système lymphatique | |||
Très fréquent : | Aplasie médullaire, neutropénie, thrombopénie, anémie, leucopénie, lymphopénie | Neutropénie, thrombopénie, anémie | Neutropénie3, thrombopénie3, anémie3, leucopénie3 |
Fréquent : | Neutropénie fébrile | Pancytopénie | Neutropénie fébrile, lymphopénie |
Peu fréquent : |
| Purpura thrombotique thrombocytopénique | pancytopénie |
Rare : | Pancytopénie |
|
|
Affections du système immunitaire | |||
Peu fréquent : | Hypersensibilité |
| Hypersensibilité médicamenteuse, hypersensibilité |
Rare : | Hypersensibilité sévère1 |
|
|
Troubles du métabolisme et de la nutrition | |||
Très fréquent : | Anorexie | Déshydratation, appétit diminué, hypokaliémie | Appétit diminué |
Fréquent : | Déshydratation, appétit diminué, hypokaliémie |
| Déshydratation |
Peu fréquent : | Hypophosphatémie, rétention hydrique, hypoalbuminémie, polydipsie, hyperglycémie, hypocalcémie, hypoglycémie, hyponatrémie |
|
|
Fréquence indéterminée : | Syndrome de lyse tumorale1 |
|
|
Affections psychiatriques | |||
Très fréquent : |
| Dépression, insomnie |
|
Fréquent : | Dépression, insomnie, anxiété | Anxiété | Insomnie |
Peu fréquent : | Impatiences |
|
|
Affections du système nerveux | |||
Très fréquent : | Neuropathie périphérique, neuropathie, hypoesthésie, paresthésie | Neuropathie périphérique, sensation vertigineuse, céphalées, dysgueusie | Neuropathie périphérique |
Fréquent : | Neuropathie périphérique sensitive, sensation vertigineuse, neuropathie motrice périphérique, ataxie, céphalées, trouble sensoriel, somnolence, dysgueusie |
| Sensation vertigineuse, céphalées, dysgueusie |
Peu fréquent : | Polyneuropathie, aréflexie, syncope, vertiges posturaux, dyskinésie, hyporéflexie, névralgie, douleur neuropathique, tremblements, perte de la sensibilité | Paralysie du septième nerf crânien |
|
Fréquence indéterminée : | Paralysies multiples des nerfs crâniens1 |
|
|
Affections oculaires | |||
Fréquent : | Vision trouble, augmentation de la sécrétion lacrymale, sécheresse oculaire, kératoconjonctivite sèche, madarose | Augmentation de la sécrétion lacrymale | Vision trouble |
Peu fréquent : | Baisse de l’acuité visuelle, vision anormale, irritation oculaire, douleur oculaire, conjonctivite, perturbation visuelle, prurit de l’œil, kératite | Œdème cystoïde maculaire |
|
Rare : | Œdème cystoïde maculaire1 |
|
|
Affections de l’oreille et du labyrinthe | |||
Fréquent : | Vertige |
|
|
Peu fréquent : | Acouphènes, douleur auriculaire |
|
|
Affections cardiaques | |||
Fréquent : | Arythmies, tachycardie, tachycardie supraventriculaire | Insuffisance cardiaque congestive, tachycardie |
|
Rare : | Arrêt cardiaque, insuffisance cardiaque congestive, dysfonctionnement ventriculaire gauche, bloc auriculo‑ventriculaire1, bradycardie |
|
|
Affections vasculaires | |||
Fréquent : | Hypertension, lymphœdème, bouffée congestive, bouffées de chaleur au visage et au cou | Hypotension, hypertension | Hypotension, hypertension |
Peu fréquent : | Hypotension, hypotension orthostatique, froideur des extrémités | Bouffée congestive | Bouffée congestive |
Rare : | Thrombose |
|
|
Affections respiratoires, thoraciques et médiastinales | |||
Très fréquent : |
| Dyspnée, épistaxis, toux | Dyspnée |
Fréquent : | Pneumopathie interstitielle2, dyspnée, épistaxis, douleur pharyngolaryngée, toux, rhinite, rhinorrhée | Pneumopathie inflammatoire, congestion nasale | Hémoptysie, épistaxis, toux |
Peu fréquent : | Embolie pulmonaire, thromboembolie pulmonaire, épanchement pleural, dyspnée d’exercice, congestion sinusienne, murmure vésiculaire diminué, toux productive, rhinite allergique, enrouement, congestion nasale, sécheresse nasale, sibilances | Gorge sèche, sécheresse nasale | Pneumopathie inflammatoire |
Fréquence indéterminée : | Parésie des cordes vocales2 |
|
|
Affections gastro‑intestinales | |||
Très fréquent : | Diarrhées, vomissements, nausées, constipation, stomatite | Diarrhées, vomissements, nausées, constipation, douleur abdominale, douleur abdominale haute | Diarrhées, vomissements, nausées, constipation, |
Fréquent : | reflux gastro‑œsophagien, dyspepsie, douleur abdominale, distension abdominale, douleur abdominale haute, hypoesthésie orale | Obstruction intestinale, colite, stomatite, bouche sèche | Stomatite, dyspepsie, dysphagie, douleur abdominale |
Peu fréquent : | Hémorragie rectale, dysphagie, flatulence, glossodynie, sécheresse buccale, douleur gingivale, selles liquides, œsophagite, douleur abdominale basse, ulcération de la bouche, douleur buccale, |
|
|
Affections hépatobiliaires | |||
Fréquent : |
| Cholangite | Hyperbilirubinémie |
Peu fréquent : | Hépatomégalie |
|
|
Affections de la peau et du tissu sous‑cutané | |||
Très fréquent : | Alopécie, rash | Alopécie, rash | Alopécie, rash |
Fréquent : | Prurit, sécheresse cutanée, trouble unguéal, érythème, altération de la couleur unguéale/pigmentation unguéale, hyperpigmentation cutanée, onycholyse, changements unguéaux | Prurit, sécheresse cutanée, trouble unguéal | Prurit, trouble unguéal |
Peu fréquent : | Réaction de photosensibilité, urticaire, peau douloureuse, prurit généralisé, éruptions prurigineuses, troubles cutanés, troubles pigmentaires, hyperhidrose, onychomadèse, éruption érythémateuse, éruption généralisée, dermatite, sueurs nocturnes, éruption maculopapuleuse, vitiligo, hypotrichose, sensibilité du lit de l’ongle, gêne au niveau de l’ongle, éruption maculaire, éruption papulaire, lésions cutanées, œdème du visage |
| Exfoliation cutanée, dermatite allergique, urticaire |
Très rare : | Syndrome de Stevens‑Johnson1, nécrolyse épidermique toxique1 |
|
|
Fréquence indéterminée : | Syndrome d'érythrodysesthésie palmo‑plantaire1,4, sclérodermie1 |
|
|
Affections musculo‑squelettiques et systémiques | |||
Très fréquent : | Arthralgie, myalgie | Arthralgie, myalgie, douleur des extrémités | Arthralgie, myalgie |
Fréquent : | Dorsalgie, douleur des extrémités, douleur osseuse, crampes musculaires, douleur des membres | Faiblesse musculaire, douleur osseuse | Dorsalgie, douleur des extrémités, douleur musculo‑squelettique |
Peu fréquent : | Douleur de la paroi thoracique, faiblesse musculaire, douleur dans le cou, douleur de l’aine, spasmes musculaires, douleur musculo‑squelettique, douleur du flanc, gêne dans les membres, faiblesse musculaire |
|
|
Affections du rein et des voies urinaires | |||
Fréquent : |
| Insuffisance rénale aiguë |
|
Peu fréquent : | Hématurie, dysurie, pollakiurie, nocturie, polyurie, incontinence urinaire | Syndrome hémolytique et urémique |
|
Affections des organes de reproduction et du sein | |||
Peu fréquent : | Seins douloureux |
|
|
Troubles généraux et anomalies au site d’administration | |||
Très fréquent : | Fatigue, asthénie, pyrexie | Fatigue, asthénie, pyrexie, œdème périphérique, tremblements | Fatigue, asthénie, œdème périphérique |
Fréquent : | Malaise, léthargie, faiblesse, œdème périphérique, inflammation des muqueuses, douleur, frissons, œdème, diminution de l’indice de performance, douleur thoracique, syndrome grippal, hyperpyrexie | Réaction au site de perfusion | Pyrexie, douleur thoracique |
Peu fréquent : | Gêne thoracique, démarche anormale, gonflement, réaction au site d’injection |
| Inflammation des muqueuses, extravasation au site de perfusion, inflammation au site de perfusion, rash au site de perfusion |
Rare : | Extravasation |
|
|
Investigations | |||
Très fréquent : |
| Perte de poids, alanine aminotransférase augmentée |
|
Fréquent | Perte de poids, alanine aminotransférase augmentée, aspartate aminotransférase augmentée, diminution de l’hématocrite, diminution de la numération des globules rouges, élévation de la température corporelle, élévation du taux des gamma‑glutamyltransférases, phosphatase alcaline sanguine augmentée | Aspartate aminotransférase augmentée, bilirubine sanguine augmentée, créatine sanguine augmentée | Perte de poids, alanine aminotransférase augmentée, aspartate aminotransférase augmentée, phosphatase alcaline sanguine augmentée |
Peu fréquent : | Pression artérielle augmentée, prise de poids, élévation du taux sanguin de lactate déshydrogénase, créatinine sanguine augmentée, augmentation de la glycémie, de la phosphorémie, hypokaliémie, hyperbilirubinémie |
|
|
Lésions, intoxications et complications liées aux procédures | |||
Peu fréquent : | Contusion |
|
|
Rare : | Réaction cutanée par réactivation de la zone antérieurement irradiée, pneumopathie radique |
|
|
1 Rapportés dans le cadre de la pharmacovigilance post commercialisation d'Abraxane.
2 La fréquence des pneumopathies est calculée à partir des données regroupées de 1 310 patients inclus dans les études cliniques recevant Abraxane en monothérapie pour un cancer du sein et dans d’autres indications.
3 Sur la base des analyses biologiques : degré maximal de myélosuppression (population traitée).
4 Chez certains patients ayant été exposés à la capécitabine.
Description de certains effets indésirables
Cette rubrique décrit les effets indésirables les plus fréquents et les plus cliniquement pertinents observés chez Abraxane.
Les effets indésirables ont été évalués chez 229 patients présentant un cancer du sein métastatique qui ont été traités par Abraxane 260 mg/m2 toutes les trois semaines dans l’étude clinique pivot de phase III (Abraxane en monothérapie).
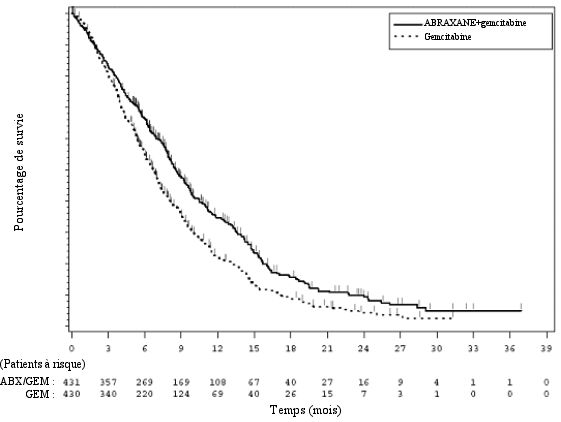
Les effets indésirables ont été évalués chez 421 patients présentant un cancer du pancréas métastatique qui ont été traités par Abraxane en association avec la gemcitabine (Abraxane 125 mg/m2 en association avec la gemcitabine à la dose de 1 000 mg/m2, administrés les jours 1, 8 et 15 de chaque cycle de 28 jours) et 402 patients recevant la gemcitabine en monothérapie en traitement systémique de première ligne d’un adénocarcinome du pancréas métastatique(Abraxane/gemcitabine).
Des effets indésirables ont été évalués chez 514 patients atteints d’un cancer bronchique non à petites cellules qui ont été traités par Abraxane en association avec le carboplatine (Abraxane 100 mg/m2, administré les jours 1, 8 et 15 de chaque cycle de 21 jours en association avec le carboplatine administré les jours 1 de chaque cycle) dans un essai clinique randomisé, contrôlé de phase III (Abraxane‑carboplatine). La toxicité des taxanes rapportée par les patients a été évaluée à l’aide des quatre sous‑échelles du questionnaire d’évaluation fonctionnelle du traitement anticancéreux Functional Assessment of Cancer Therapy (FACT)‑Taxane. Dans une analyse pour mesures répétées, trois des quatre sous‑échelles (neuropathie périphérique, douleurs dans les mains et les pieds et audition) ont été en faveur d’Abraxane en association avec le carboplatine (P ≤ 0,002). Pour l’autre sous‑échelle (œdème), il n’a pas été observé de différence entre les bras de traitement.
Infections et infestations
Abraxane/gemcitabine
Une septicémie a été rapportée avec une incidence de 5 % chez les patients présentant ou non une neutropénie, qui recevaient l’association Abraxane – gemcitabine dans une étude menée dans l’adénocarcinome du pancréas. Sur les 22 cas de septicémies rapportés chez les patients traités par Abraxane en association avec la gemcitabine, 5 ont été d’issues fatales. Des complications liées au cancer du pancréas sous‑jacent, en particulier une obstruction biliaire ou la présence d’un stent biliaire, ont été identifiés comme étant des facteurs favorisants significatifs. Si un patient développe une fièvre (quel que soit le taux de neutrophiles), une antibiothérapie à large spectre doit être instaurée. En cas de neutropénie fébrile, l’administration d’Abraxane et de gemcitabine doit être suspendue jusqu’à ce que la fièvre ait disparu et que le taux de neutrophiles soit ≥ 1 500/mm3, puis le traitement sera repris à doses réduites (voir rubrique 4.2).
Affections hématologiques et du système lymphatique
Abraxane en monothérapie – cancer du sein métastatique
Chez les patients atteints d’un cancer du sein métastatique, la neutropénie se distinguait comme la plus importante toxicité hématologique (signalée chez 79 % des patients) et était rapidement réversible et dose‑dépendante ; la leucopénie a été signalée chez 71 % des patients. Une neutropénie de grade 4 (< 500/mm3) est survenue chez 9 % des patients traités par Abraxane. Une neutropénie fébrile est apparue chez quatre patients sous Abraxane. Une anémie (Hb < 10 g/dl) a été observée chez 46 % des patients sous Abraxane et a été sévère (Hb < 8 g/dl) dans trois cas. Une lymphopénie a été observée chez 45 % des patients.
Abraxane/gemcitabine
Le tableau 7 présente la fréquence et la sévérité des anomalies des paramètres hématologiques chez les patients traités par Abraxane en association avec la gemcitabine ou par la gemcitabine en monothérapie.
Tableau 7 : Anomalies des paramètres hématologiques dans l’étude de l’adénocarcinome du pancréas
| Abraxane (125 mg/m2)/ gemcitabine | Gemcitabine | ||
Grades 1‑4 | Grades 3‑4 | Grades 1‑4 | Grades 3‑4 | |
Anémiea,b | 97 | 13 | 96 | 12 |
Neutropéniea,b | 73 | 38 | 58 | 27 |
Thrombopénieb,c | 74 | 13 | 70 | 9 |
a 405 patients évalués dans le groupe traité par Abraxane/gemcitabine.
b 388 patients évalués dans le groupe traité par gemcitabine.
c 404 patients évalués dans le groupe traité par Abraxane/gemcitabine.
Abraxane/carboplatine
L’anémie et la thrombopénie ont été rapportées plus fréquemment dans le bras Abraxane et carboplatine que dans le bras Taxol et carboplatine (54 % versus 28 % et 45 % versus 27 % respectivement).
Affections du système nerveux
Abraxane en monothérapie – cancer du sein métastatique
Généralement, la fréquence et la sévérité de la neurotoxicité étaient dose‑dépendantes chez les patients recevant Abraxane. Une neuropathie périphérique (le plus souvent une neuropathie sensitive de grade 1 ou 2) a été observée chez 68 % des patients sous Abraxane dont 10 % de grade 3, et aucune de grade 4.
Abraxane/gemcitabine
Chez les patients traités par Abraxane en association avec la gemcitabine, le délai médian jusqu’à la première survenue de neuropathie périphérique de grade 3 a été de 140 jours. Le délai médian jusqu’à l’amélioration d’au moins un grade a été de 21 jours et le délai médian jusqu’à la régression de la neuropathie périphérique du grade 3 au grade 0 ou 1 a été de 29 jours. Chez les patients dont le traitement avait été interrompu en raison d’une neuropathie périphérique, le traitement par Abraxane a pu être repris à dose réduite pour 44 % d’entre eux (31 patients sur 70). Aucun patient traité par Abraxane en association avec la gemcitabine n’a présenté de neuropathie périphérique de grade 4.
Abraxane/carboplatine
Chez les patients atteints d’un cancer bronchique non à petites cellules traités par Abraxane et le carboplatine, le délai médian jusqu’à la première survenue de neuropathie périphérique de grade 3 liée au traitement a été de 121 jours et le délai médian jusqu’à la régression du grade 3 au grade 1 a été de 38 jours. Aucun patient traité par Abraxane et le carboplatine n’a présenté de neuropathie périphérique de grade 4.
Affections oculaires
Au cours de la surveillance post‑commercialisation, de rares cas de baisse d’acuité visuelle due à un œdème cystoïde maculaire ont été rapportés pendant le traitement par Abraxane (voir rubrique 4.4).
Affections respiratoires, thoraciques et médiastinales
Abraxane/gemcitabine
Une pneumopathie a été rapportée avec une incidence de 4 % pendant le traitement par Abraxane en association avec la gemcitabine. Sur les 17 cas de pneumopathie observés chez les patients traités par Abraxane en association avec la gemcitabine, deux ont été d’issue fatale. Les patients doivent être surveillés étroitement pour détecter des signes ou symptômes de pneumopathie. Si une pneumopathie est diagnostiquée et qu’une étiologie infectieuse est exclue, le traitement par Abraxane et la gemcitabine doit être arrêté définitivement et un traitement de support approprié doit être instauré rapidement (voir rubrique 4.2).
Affections gastro‑intestinales
Abraxane en monothérapie – cancer du sein métastatique
Des nausées ont été rapportées chez 29 % des patients et une diarrhée chez 25 % des patients.
Affections de la peau et du tissu sous‑cutané
Abraxane en monothérapie – cancer du sein métastatique
Une alopécie a été observée chez plus de 80 % des patients traitées par Abraxane. Dans la majorité des cas, l’alopécie est survenue moins d’un mois après l’instauration du traitement par Abraxane. Une perte importante d’au moins 50 % des cheveux est attendue chez la majorité des patients qui présentent une alopécie.
Affections musculo‑squelettiques et systémiques
Abraxane en monothérapie – cancer du sein métastatique
Des arthralgies sont survenues chez 32 % des patients sous Abraxane et ont été sévères dans 6 % des cas. Des myalgies sont survenues chez 24 % des patients sous Abraxane et ont été sévères dans 7 % des cas. Les symptômes étaient habituellement transitoires, apparaissaient typiquement trois jours après l’administration d’Abraxane et étaient résolus dans la semaine suivante.
Troubles généraux et anomalies au site d’administration
Abraxane en monothérapie – cancer du sein métastatique
Une asthénie/fatigue a été signalée chez 40 % des patients.
Population pédiatrique
L’étude comptait 106 patients, dont 104 étaient des patients pédiatriques âgés de 6 mois à moins de 18 ans (voir rubrique 5.1). Chaque patient a présenté au moins un effet indésirable. Les effets indésirables les plus fréquemment signalés étaient la neutropénie, l’anémie, la leucopénie et la fièvre. Les effets indésirables graves signalés chez plus de deux patients étaient la fièvre, des douleurs dorsales, un œdème périphérique et des vomissements. Aucun nouveau signal relatif à la sécurité d’emploi n’a été identifié parmi le nombre limité de patients pédiatriques traités par Abraxane, et le profil de sécurité d’emploi était similaire à celui observé dans la population adulte.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration –Annexe V.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Bristol‑Myers Squibb Pharma EEIG
Plaza 254
Blanchardstown Corporate Park 2
Dublin 15, D15 T867
Irlande
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/07/428/001
EU/1/07/428/002
10. DATE DE MISE À JOUR DU TEXTE
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2834786 | ABRAXANE 5 MG/ML 100 MG PDR SUSP INJ PERF FL 1 | L01CD01 | - | € 190,91 | Oui | - | - |