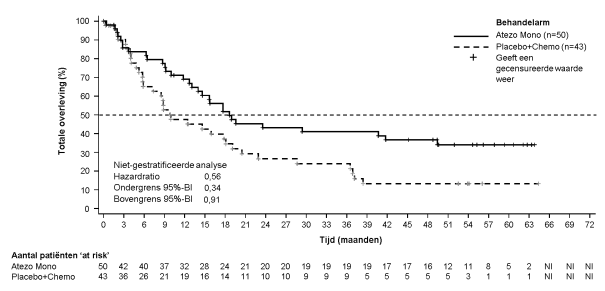
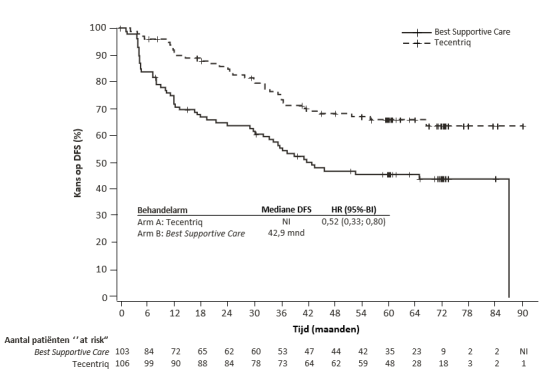
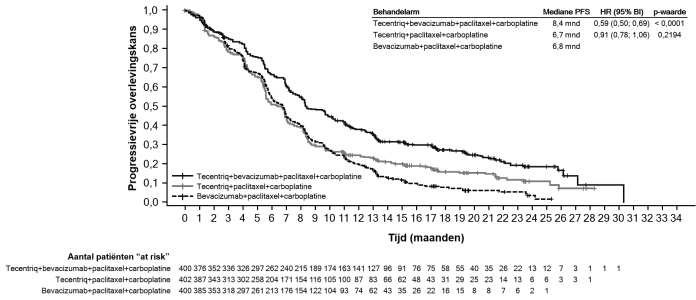
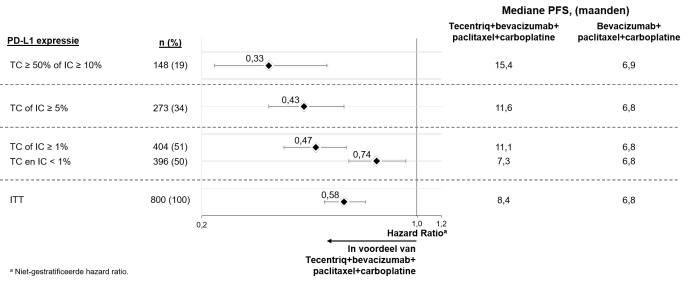
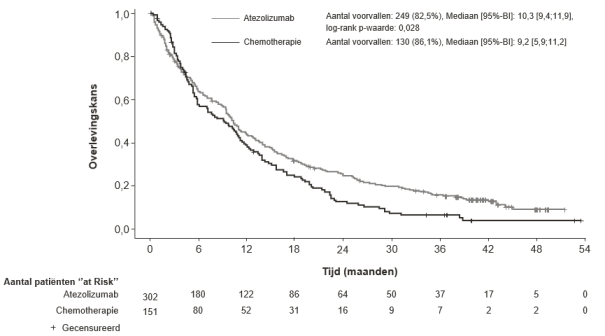
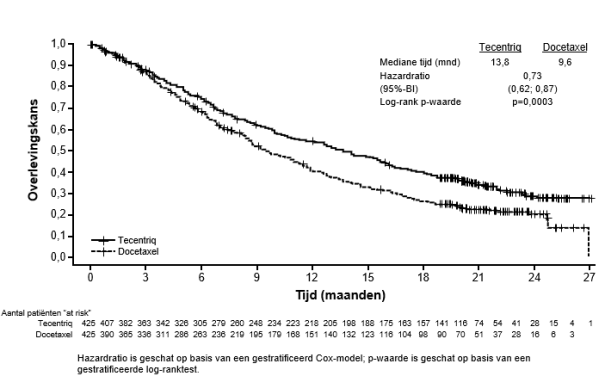
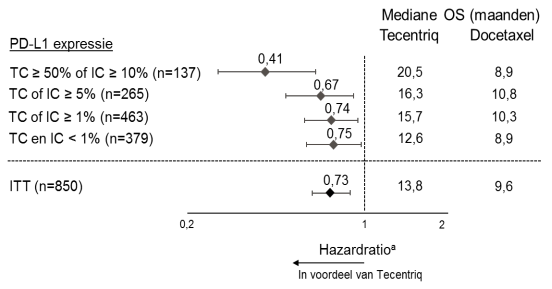
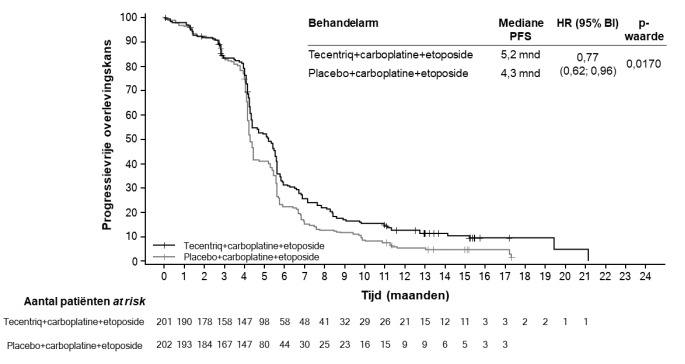
SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Tecentriq 840 mg concentraat voor oplossing voor infusie
Tecentriq 1.200 mg concentraat voor oplossing voor infusie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Tecentriq 840 mg concentraat voor oplossing voor infusie
Elke injectieflacon van 14 ml concentraat bevat 840 mg atezolizumab*
Tecentriq 1.200 mg concentraat voor oplossing voor infusie
Elke injectieflacon van 20 ml concentraat bevat 1.200 mg atezolizumab*
Na verdunning (zie rubriek 6.6) moet de uiteindelijke concentratie van de verdunde oplossing tussen 3,2 en 16,8 mg/ml liggen.
*Atezolizumab is een Fc‑gemodificeerd, gehumaniseerd IgG1 anti‑programmed death‑ligand 1 (PD‑L1) monoklonaal antilichaam, geproduceerd in ovariumcellen van de Chinese hamster door middel van recombinant-DNA-technologie.
Hulpstof met bekend effect
Elke injectieflacon van 840 mg Tecentriq bevat 5,6 mg polysorbaat 20.
Elke injectieflacon van 1.200 mg Tecentriq bevat 8 mg polysorbaat 20.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Concentraat voor oplossing voor infusie.
Heldere, kleurloze tot lichtgele vloeistof. De oplossing heeft een pH van 5,5 – 6,1 en een osmolaliteit van 129 – 229 mOsm/kg.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Urotheelcarcinoom (UC)
Tecentriq is als monotherapie geïndiceerd voor de behandeling van volwassen patiënten met lokaal gevorderd of gemetastaseerd UC:
na eerdere behandeling met platina-bevattende chemotherapie, of
voor wie cisplatine ongeschikt is en bij wie de tumoren een PD-L1-expressie hebben van ≥ 5% (zie rubriek 5.1).
Niet-kleincellig longcarcinoom (NSCLC) in een vroeg stadium
Tecentriq is als monotherapie geïndiceerd als adjuvante behandeling na volledige resectie en platina-bevattende chemotherapie voor volwassen patiënten met NSCLC met een hoog risico op recidief bij wie de tumoren PD-L1-expressie hebben op ≥ 50% van de tumorcellen (TC) en die geen EGFR-mutatie of ALK-positieve NSCLC hebben (zie rubriek 5.1 voor selectiecriteria).
Gevorderd NSCLC
Tecentriq, in combinatie met bevacizumab, paclitaxel en carboplatine, is geïndiceerd voor de eerstelijnsbehandeling van volwassen patiënten met gemetastaseerd NSCLC. Bij patiënten met EGFR-gemuteerd of ALK-positief NSCLC is Tecentriq, in combinatie met bevacizumab, paclitaxel en carboplatine, alleen geïndiceerd na falen van geschikte doelgerichte behandelingen (zie rubriek 5.1).
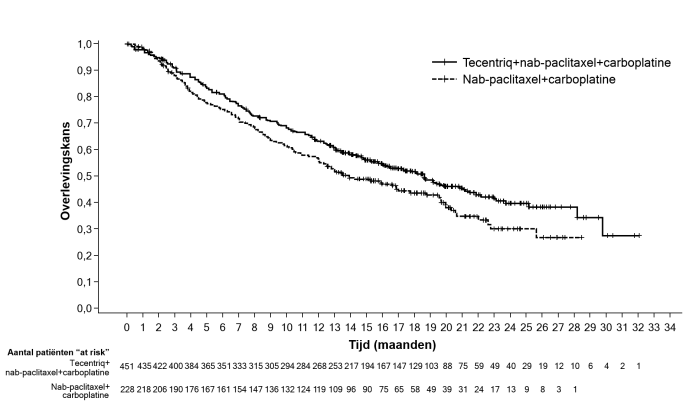
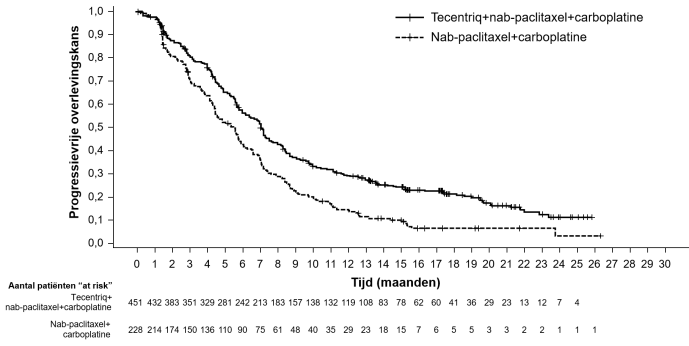
Tecentriq, in combinatie met nab-paclitaxel en carboplatine, is geïndiceerd voor de eerstelijnsbehandeling van volwassen patiënten met gemetastaseerd niet-plaveiselcel-NSCLC, die geen EGFR-gemuteerd of ALK-positief NSCLC hebben (zie rubriek 5.1).
Tecentriq is als monotherapie geïndiceerd voor de eerstelijnsbehandeling van volwassen patiënten met gemetastaseerd NSCLC bij wie de tumoren een PD-L1-expressie hebben op ≥ 50% TC of ≥ 10% tumorinfiltrerende immuuncellen (IC) en die geen EGFR-gemuteerd of ALK‑positief NSCLC hebben (zie rubriek 5.1).
Tecentriq is als monotherapie geïndiceerd voor de eerstelijnsbehandeling van volwassen patiënten met gevorderd NSCLC, die niet in aanmerking komen voor platina-bevattende behandeling (zie rubriek 5.1 voor selectiecriteria).
Tecentriq is als monotherapie geïndiceerd voor de behandeling van volwassen patiënten met lokaal gevorderd of gemetastaseerd NSCLC na eerdere behandeling met chemotherapie. Patiënten met EGFR-gemuteerd of ALK‑positief NSCLC moeten ook doelgerichte behandelingen hebben ontvangen voor ze Tecentriq krijgen (zie rubriek 5.1).
Kleincellig longcarcinoom (SCLC)
Tecentriq, in combinatie met carboplatine en etoposide, is geïndiceerd voor de eerstelijnsbehandeling van volwassen patiënten met extensive-stage kleincellig longcarcinoom (ES-SCLC) (zie rubriek 5.1).
Triple-negatieve borstkanker (TNBC)
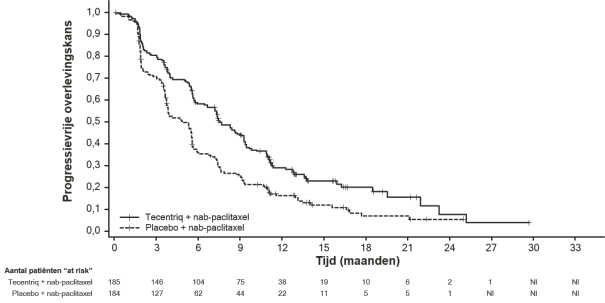
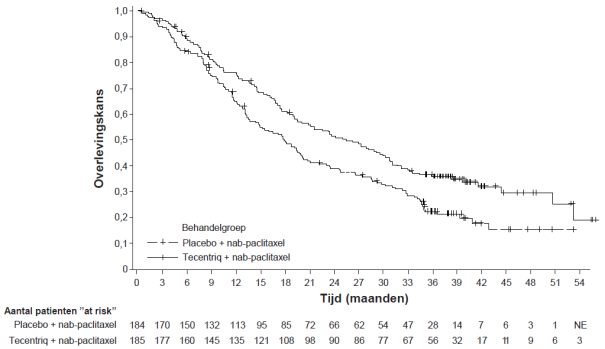
Tecentriq, in combinatie met nab-paclitaxel, is geïndiceerd voor de behandeling van volwassen patiënten met inoperabele lokaal gevorderde of gemetastaseerde TNBC bij wie de tumoren een PD-L1-expressie hebben van ≥ 1% en die niet eerder chemotherapie voor gemetastaseerde ziekte hebben ontvangen.
Hepatocellulair carcinoom (HCC)
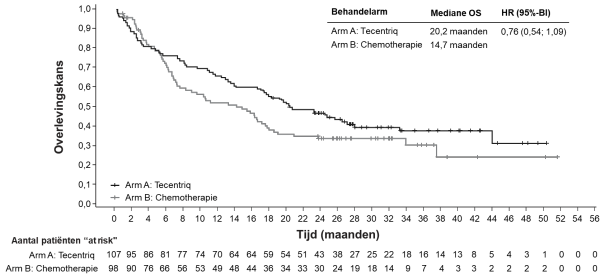
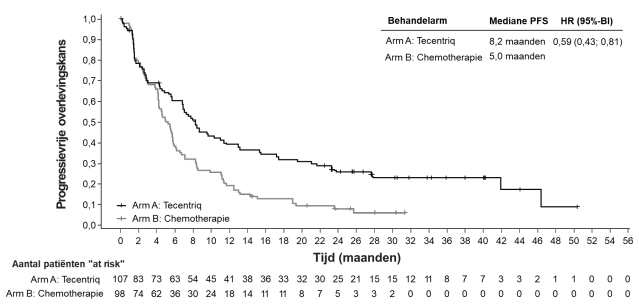
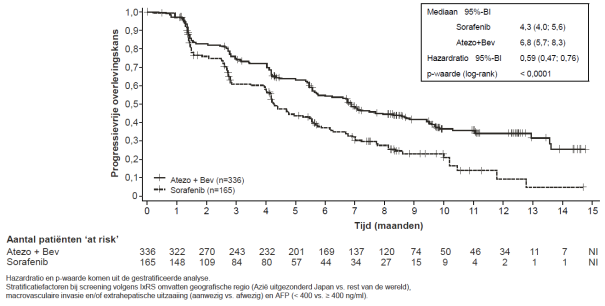
Tecentriq, in combinatie met bevacizumab, is geïndiceerd voor de behandeling van volwassen patiënten met gevorderd of inoperabel HCC die niet eerder zijn behandeld met systemische therapie (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Tecentriq moet geïnitieerd worden door en onder toezicht plaats vinden van een bevoegd arts met ervaring in de behandeling van kanker.
PD-L1-test bij patiënten met UC of TNBC of NSCLC
Tecentriq-monotherapie
Indien benoemd in de indicatie moet PD-L1-expressie in de tumor worden bevestigd door een gevalideerde test (zie rubriek 4.1 en 5.1) alvorens een patiënt te behandelen met Tecentriq.
Tecentriq-combinatietherapie
Patiënten met niet eerder behandeld TNBC moeten worden geselecteerd voor behandeling op basis van de tumor PD-L1-expressie bevestigd door een gevalideerde test (zie rubriek 5.1).
Dosering
De aanbevolen dosering van Tecentriq is een intraveneuze toediening van 840 mg elke twee weken, of 1.200 mg elke drie weken, of 1.680 mg elke vier weken, zoals weergegeven in Tabel 1.
Indien Tecentriq wordt gegeven als combinatietherapie: zie ook de volledige productinformatie van de combinatiemiddelen (zie ook rubriek 5.1)
Tabel 1: Aanbevolen dosering voor Tecentriq per intraveneuze toediening
Indicatie | Aanbevolen dosering en schema | Duur van de behandeling |
Tecentriq-monotherapie |
| |
Eerstelijns UC | 840 mg elke 2 weken of | Tot ziekteprogressie of onaanvaardbare toxiciteit. |
Eerstelijns gemetastaseerd NSCLC | ||
Eerstelijns NSCLC die niet in aanmerking komt voor platina-bevattende behandeling | ||
NSCLC in een vroeg stadium | • 840 mg elke 2 weken of | Gedurende 1 jaar, tenzij terugkeer van ziekte of onaanvaardbare toxiciteit. Een behandelduur van meer dan 1 jaar werd niet onderzocht. |
Tweedelijns UC | 840 mg elke 2 weken of | Tot verlies van klinisch voordeel of onaanvaardbare toxiciteit. |
Tweedelijns NSCLC | ||
Tecentriq-combinatietherapie | ||
Eerstelijns niet‑plaveiselcel‑NSCLC | Inductie- en onderhoudsfases: | Tot ziekteprogressie of onaanvaardbare toxiciteit. |
Eerstelijns niet‑plaveiselcel‑NSCLC | Inductie- en onderhoudsfases: | Tot ziekteprogressie of onaanvaardbare toxiciteit. |
Eerstelijns ES-SCLC | Inductie- en onderhoudsfases: | Tot ziekteprogressie of onaanvaardbare toxiciteit. |
Eerstelijns inoperabele lokaal gevorderde of gemetastaseerde TNBC met nab‑paclitaxel | 840 mg elke 2 weken of | Tot ziekteprogressie of onaanvaardbare toxiciteit |
Gevorderd of inoperabel HCC met bevacizumab | 840 mg elke 2 weken of | Tot verlies van klinisch voordeel of onaanvaardbare toxiciteit. |
Uitgestelde of gemiste doses
Wanneer een geplande dosis van Tecentriq wordt gemist, moet die zo snel mogelijk toegediend worden. Het toedieningsschema moet zo aangepast worden dat de tijd tussen de doses de juiste blijft.
Dosisaanpassingen tijdens de behandeling
Dosisverlagingen van Tecentriq worden niet aanbevolen.
Uitstel van de dosering of beëindiging van de behandeling (zie ook rubrieken 4.4 en 4.8)
Tabel 2: Advies voor dosisaanpassing van Tecentriq
Immuungemedieerde bijwerking | Ernst | Behandelingsaanpassing |
Pneumonitis | Graad 2 | Onderbreek Tecentriq |
| Graad 3 of 4 | Tecentriq definitief staken |
Hepatitis bij patiënten zonder HCC | Graad 2: | Onderbreek Tecentriq |
| Graad 3 of 4: | Tecentriq definitief staken |
Hepatitis bij patiënten met HCC | Als ASAT/ALAT binnen de grenzen van normaal is bij baseline en toeneemt naar > 3 tot ≤ 10 x ULN | Onderbreek Tecentriq |
| Als ASAT/ALAT toeneemt naar > 10 x ULN | Tecentriq definitief staken |
Colitis | Graad 2 of 3 diarree (toename van ≥ 4 ontlastingen/dag t.o.v. baseline) | Onderbreek Tecentriq |
| Graad 4 diarree of colitis (levensbedreigend; dringend interventie vereist) | Tecentriq definitief staken |
Hypothyreoïdie of hyperthyreoïdie | Symptomatisch | Onderbreek Tecentriq |
Bijnierinsufficiëntie | Symptomatisch | Onderbreek Tecentriq |
Hypofysitis | Graad 2 of 3 | Onderbreek Tecentriq |
Graad 4 | Tecentriq definitief staken | |
Diabetes mellitus type 1 | Graad 3 of 4 hyperglykemie (nuchtere glucosewaarde > 250 mg/dl of 13,9 mmol/l) | Onderbreek Tecentriq |
Huiduitslag / ernstige huidgerelateerde bijwerkingen (SCAR’s) | Graad 3 | Onderbreek Tecentriq |
| Graad 4 | Tecentriq definitief staken |
Myastheen syndroom / myasthenia gravis, syndroom van Guillain‑Barré, meningo-encefalitis en gelaatsparese | Gelaatsparese graad 1 of 2 | Onderbreek Tecentriq |
Alle graden myastheen syndroom / myasthenia gravis, syndroom van Guillain Barré en meningo-encefalitis | Tecentriq definitief staken | |
Myelitis | Graad 2, 3 of 4 | Tecentriq definitief staken |
Pancreatitis | Graad 3 of 4, verhoogde amylase- of lipasewaarden in serum (> 2 x ULN) | Onderbreek Tecentriq |
Graad 4 pancreatitis of elke graad bij terugkerende pancreatitis | Tecentriq definitief staken | |
Myocarditis | Graad 2 of hoger | Tecentriq definitief staken |
Nefritis | Graad 2: | Onderbreek Tecentriq |
Graad 3 of 4: | Tecentriq definitief staken | |
Myositis | Graad 2 of 3 | Onderbreek Tecentriq |
Graad 4 of terugkerende graad 3 myositis | Tecentriq definitief staken | |
Pericardaandoeningen | Graad 1 pericarditis | Onderbreek Tecentriq2 |
Graad 2 of hoger | Tecentriq definitief staken | |
Hemofagocytaire lymfohistiocytose | Vermoedelijke hemofagocytaire lymfohistiocytose1 | Tecentriq definitief staken |
Andere immuungemedieerde bijwerkingen | Graad 2 of 3 | Onderbreek Tecentriq |
Graad 4 of terugkerende graad 3 | Tecentriq definitief staken (behalve bij endocrinopathieën die onder controle zijn met vervangende hormonen) | |
Andere bijwerkingen | Ernst | Behandelingsaanpassing |
Infusiegerelateerde reacties | Graad 1 of 2 | Verlaag de infusiesnelheid of onderbreek de behandeling |
Graad 3 of 4 | Tecentriq definitief staken |
ALAT = alanineaminotransferase; ASAT = aspartaataminotransferase; ULN = bovengrens van normaal. Opmerking: gradering voor toxiciteit moet volgens de huidige versie van de National Cancer Institute Common Terminology Criteria for Adverse Events (NCI‑CTCAE).
1 Ongeacht de ernst
2 Voer een uitvoerig hartonderzoek uit om de oorzaak te achterhalen en om een geschikte behandeling vast te stellen
Speciale populaties
Pediatrische patiënten
De veiligheid en werkzaamheid van Tecentriq bij kinderen en adolescenten jonger dan 18 jaar zijn niet vastgesteld. De momenteel beschikbare gegevens worden beschreven in rubrieken 4.8, 5.1 en 5.2, maar er kan geen doseringsadvies worden gegeven.
Ouderen
Gebaseerd op een populatiefarmacokinetische (PK)-analyse is er geen dosisaanpassing van Tecentriq nodig bij patiënten ≥ 65 jaar (zie rubrieken 4.8 en 5.1).
Aziatische patiënten
Vanwege een waargenomen stijging in hematologische toxiciteiten bij Aziatische patiënten in onderzoek IMpower150, wordt een startdosering geadviseerd van paclitaxel 175 mg/m2 elke drie weken.
Verminderde nierfunctie
Gebaseerd op een populatie-PK-analyse is er geen dosisaanpassing nodig bij patiënten met een licht of matig verminderde nierfunctie (zie rubriek 5.2). De gegevens van patiënten met een ernstig verminderde nierfunctie zijn te beperkt om conclusies te kunnen trekken over deze populatie.
Verminderde leverfunctie
Gebaseerd op een populatie-PK-analyse is er geen dosisaanpassing nodig bij patiënten met een licht of matig verminderde leverfunctie. Tecentriq is niet onderzocht bij patiënten met een ernstig verminderde leverfunctie (zie rubriek 5.2).
Eastern Cooperative Oncology Group (ECOG)-score ≥ 2
Patiënten met een ECOG-score ≥ 2 werden uitgesloten voor deelname aan klinische onderzoeken naar TNBC, ES-SCLC, 2e-lijns UC en HCC (zie rubrieken 4.4 en 5.1).
Wijze van toediening
Het is van belang om de etikettering op het product te controleren om er zeker van te zijn dat de juiste formulering (intraveneus of subcutaan) aan de patiënt gegeven wordt en dat die overeenkomt met hetgeen wat voorgeschreven is aan de patiënt.
De intraveneuze formulering van Tecentriq is niet bedoeld voor subcutaan gebruik en mag alleen via een intraveneuze infusie toegediend worden.
De infusies mogen niet als intraveneuze injectie of bolus worden toegediend.
Patiënten die momenteel behandeld worden met intraveneus Tecentriq, kunnen overstappen op atezolizumab oplossing voor injectie of vice versa.
De aanvangsdosis van intraveneus Tecentriq moet gedurende een periode van 60 minuten worden toegediend. Als de eerste infusie goed wordt verdragen, dan kunnen alle daarop volgende infusies gedurende 30 minuten worden toegediend.
Voor instructies over verdunning en hanteren van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De veiligheid van atezolizumab als monotherapie is gebaseerd op gepoolde gegevens van 5.039 patiënten met meerdere tumortypes. De vaakst voorkomende bijwerkingen (> 10%) waren vermoeidheid (29,3%), verminderde eetlust (20,1%), huiduitslag (19,7%), misselijkheid (18,8%), hoesten (18,2%), diarree (18,1%), pyrexie (17,9%), dyspneu (16,6%), artralgie (16,2%), pruritus (13,3%), asthenie (13%), rugpijn (12,2%), braken (11,7%), urineweginfectie (11,0%) en hoofdpijn (10,2%).
De veiligheid van atezolizumab gegeven in combinatie met andere geneesmiddelen is onderzocht bij 4.535 patiënten en meerdere tumortypes. De vaakst voorkomende bijwerkingen (≥ 20%) waren anemie (36,8%), neutropenie (36,6%), misselijkheid (35,5%), vermoeidheid (33,1%), alopecia (28,1%), huiduitslag (27,8%), diarree (27,6%), trombocytopenie (27,1%), constipatie (25,8%), verminderde eetlust (24,7%) en perifere neuropathie (24,4%).
Gebruik van atezolizumab in de adjuvante NSCLC-setting
Het veiligheidsprofiel van atezolizumab in de adjuvante setting in de NSCLC-patiëntenpopulatie (IMpower010) was over het algemeen consistent met het algehele gepoolde veiligheidsprofiel van monotherapie in de gevorderde setting. Desalniettemin was de incidentie van immuungemedieerde bijwerkingen van atezolizumab bij IMpower010 51,7% vergeleken met 38,4% in de gepoolde monotherapiepopulatie met gevorderde ziekte. Er werden geen nieuwe immuungemedieerde bijwerkingen geïdentificeerd in de adjuvante setting.
Gebruik van atezolizumab in combinatie met bevacizumab, paclitaxel en carboplatine
In het eerstelijns NSCLC-onderzoek (IMpower150) werd een algemeen hogere frequentie van bijwerkingen gezien bij het behandelregime met de vier geneesmiddelen atezolizumab, bevacizumab, paclitaxel en carboplatine, vergeleken met atezolizumab, paclitaxel en carboplatine. Dit betrof graad 3 en 4 bijwerkingen (63,6% vergeleken met 57,5%), graad 5 bijwerkingen (6,1% vergeleken met 2,5%), bijwerkingen van atezolizumab van bijzonder belang (52,4% vergeleken met 48,0%) en bijwerkingen die tot staking van de onderzoeksbehandeling leiden (33,8% vergeleken met 13,3%). Misselijkheid, diarree, stomatitis, vermoeidheid, pyrexie, slijmvliesontsteking, verminderde eetlust, gewichtsafname, hypertensie en proteïnurie werden vaker gemeld (≥ 5% verschil) bij patiënten die atezolizumab in combinatie met bevacizumab, paclitaxel en carboplatine kregen. Andere klinisch significante bijwerkingen die vaker werden gezien in de arm met atezolizumab, bevacizumab, paclitaxel en carboplatine waren epistaxis, hemoptoë en cerebrovasculair accident, waaronder fatale gevallen.
Meer details over ernstige bijwerkingen staan in rubriek 4.4.
Lijst van bijwerkingen in tabelvorm
De bijwerkingen worden weergegeven volgens MedDRA systeem/orgaanklasse en frequentiecategorie in tabel 3 voor atezolizumab gegeven als monotherapie of als combinatietherapie. Bijwerkingen waarvan bekend is dat ze kunnen optreden wanneer atezolizumab of chemotherapie alleen wordt gebruikt, kunnen ook optreden wanneer deze middelen in combinatie worden gebruikt, zelfs als deze bijwerkingen niet gemeld werden tijdens klinische onderzoeken met de combinatietherapie. De volgende frequentiecategorieën zijn gebruikt: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000), niet bekend (kan niet worden bepaald op basis van de beschikbare gegevens). Binnen elke frequentiegroep zijn de bijwerkingen gerangschikt naar afnemende ernst.
Tabel 3: Samenvatting van bijwerkingen die optraden bij patiënten die met atezolizumab werden behandeld
Atezolizumab-monotherapie | Atezolizumab in combinatietherapie | |
Infecties en parasitaire aandoeningen | ||
Zeer vaak | Urineweginfectiea | Longinfectieb |
Vaak |
| Sepsisaj |
Zelden | Cytomegalovirusinfectie | Cytomegalovirusinfectie |
Bloed- en lymfestelselaandoeningen | ||
Zeer vaak |
| Anemie, trombocytopenied, neutropeniee, leukopenief |
Vaak | Trombocytopenied | Lymfopenieg |
Zelden | Hemofagocytaire lymfohistiocytose | Hemofagocytaire lymfohistiocytose |
Immuunsysteemaandoeningen | ||
Vaak | Infusiegerelateerde reactieh | Infusiegerelateerde reactieh |
Zelden | Sarcoïdosear |
|
Endocriene aandoeningen | ||
Zeer vaak |
| Hypothyreoïdiei |
Vaak | Hypothyreoïdiei, hyperthyreoïdiej | Hyperthyreoïdiej |
Soms | Diabetes mellitusk, bijnierinsufficiëntiel, hypofysitism | hypofysitism |
Voedings- en stofwisselingsstoornissen | ||
Zeer vaak | Verminderde eetlust | Verminderde eetlust |
Vaak | Hypokaliëmieae, hyponatriëmieaf, hyperglykemie | Hypokaliëmieae, hyponatriëmieaf, hypomagnesiëmien |
Zenuwstelselaandoeningen | ||
Zeer vaak | Hoofdpijn | Perifere neuropathieo, hoofdpijn |
Vaak | Perifere neuropathieo | Syncope, duizeligheid |
Soms | Syndroom van Guillain‑Barrép, meningo-encefalitisq |
|
Zelden | Myastheen syndroomr, gelaatsparese, myelitis | Gelaatsparese |
Oogaandoeningen | ||
Soms | Uveïtisas |
|
Zelden |
| Uveïtisas |
Hartaandoeningen | ||
Vaak | Pericardaandoeningenao |
|
Soms |
| Pericardaandoeningenao |
Zelden | Myocarditiss |
|
Bloedvataandoeningen | ||
Zeer vaak |
| Hypertensieai |
Vaak | Hypotensie |
|
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | ||
Zeer vaak | Dyspneu, hoesten | Dyspneu, hoesten, nasofaryngitisam |
Vaak | Pneumonitist, hypoxieag, nasofaryngitisam | Dysfonie |
Maagdarmstelselaandoeningen | ||
Zeer vaak | Misselijkheid, braken, diarreeu | Misselijkheid, braken, diarreeu, obstipatie |
Vaak | Colitisv, buikpijn, dysfagie, orofaryngeale pijnw, droge mond | Stomatitis, dysgeusie, colitisv |
Soms | Pancreatitisx |
|
Zelden | Coeliakie | Coeliakie |
Lever- en galaandoeningen | ||
Vaak | Verhoogd ASAT, verhoogd ALAT, hepatitisy | Verhoogd ASAT, verhoogd ALAT |
Huid- en onderhuidaandoeningen | ||
Zeer vaak | Huiduitslagz, pruritus | Huiduitslagz, pruritus, alopeciaah |
Vaak | Droge huidap |
|
Soms | Ernstige huidgerelateerde bijwerking (SCAR)ak, psoriasisan, lichen-aandoeningenaq | Ernstige huidgerelateerde bijwerking (SCAR)ak, psoriasisan |
Zelden | Pemfigoïd | Pemfigoïd, lichen-aandoeningenaq |
Skeletspierstelsel- en bindweefselaandoeningen | ||
Zeer vaak | Artralgie, rugpijn | Artralgie, musculoskeletale pijnaa, rugpijn |
Vaak | Musculoskeletale pijnaa, artritisat | Artritisat |
Soms | Myositisab, tenosynovitisau | Tenosynovitisau |
Nier- en urinewegaandoeningen | ||
Vaak | Verhoogd creatinine in het bloedc | Proteïnurieac, verhoogd creatinine in het bloedc |
Soms | Nefritisad |
|
Niet bekend | Niet-infectieuze cystitisal |
|
Algemene aandoeningen en toedieningsplaatsstoornissen | ||
Zeer vaak | Pyrexie, vermoeidheid, asthenie | Pyrexie, vermoeidheid, asthenie, oedeem perifeer |
Vaak | Griepachtige verschijnselen, rillingen |
|
Onderzoeken | ||
Vaak |
| Verhoogde alkalische fosfatase in het bloed |
Soms | Verhoogd creatinefosfokinase in het bloed |
|
a Waaronder meldingen van urineweginfectie, cystitis, pyelonefritis, Escherichia-urineweginfectie, bacteriële urineweginfectie, nierinfectie, acute pyelonefritis, chronische pyelonefritis, pyelitis, nierabces, urineweginfectie door streptokokken, urethritis, fungale urineweginfectie, pseudomonale urineweginfectie.
b Waaronder meldingen van pneumonie, bronchitis, lagere luchtweginfectie, infectieuze pleurale effusie, tracheobronchitis, atypische pneumonie, longabces, infectieuze exacerbatie van chronische obstructieve luchtwegaandoening, paracancereuze pneumonie, pyopneumothorax, pleurale infectie, postprocedurele pneumonie.
c Waaronder meldingen van verhoogd creatinine in het bloed, hypercreatininemie.
d Waaronder meldingen van immune trombocytopenie (gemeld in onderzoeken buiten de gepoolde gegevensset), trombocytopenie, verlaagd aantal bloedplaatjes.
e Waaronder meldingen van neutropenie, verlaagd aantal neutrofielen, febriele neutropenie, neutropene sepsis, granulocytopenie.
f Waaronder meldingen van verminderd aantal witte bloedcellen, leukopenie.
g Waaronder meldingen van lymfopenie, verlaagd aantal lymfocyten.
h Waaronder meldingen van infusiegerelateerde reactie, cytokine release-syndroom, overgevoeligheid, anafylaxie.
i Waaronder meldingen van positieve test voor antithyreoïd-antilichamen, auto-immuunhypothyreoïdie, auto-immuunthyreoïditis, verlaagd thyreoïdstimulerend hormoon in het bloed, verhoogd thyreoïdstimulerend hormoon in het bloed, euthyroid sick syndrome, struma, hypothyreoïdie, immuungemedieerde hypothyreoïdie, immuungemedieerde thyreoïditis, myxoedeem, primaire hypothyreoïdie, schildklieraandoening, verlaagd schildklierhormoon, afwijkende schildklierfunctietest, thyreoïditis, acute thyreoïditis, verlaagd thyroxine, verlaagd vrij thyroxine, verhoogd vrij thyroxine, verhoogd thyroxine, verlaagd tri‑jodothyronine, tri-jodothyronine verhoogd, afwijkend vrij tri-jodothyronine, verlaagd vrij tri‑jodothyronine, verhoogd vrij tri-jodothyronine, pijnloze thyreoïditis.
j Waaronder meldingen van hyperthyreoïdie, ziekte van Basedow, endocriene oftalmopathie, exoftalmie.
k Waaronder meldingen van diabetes mellitus, diabetes mellitus type 1, diabetische ketoacidose, ketoacidose.
l Waaronder meldingen van bijnierinsufficiëntie, verlaagd corticotropine in het bloed, glucocorticoïdendeficiëntie, primaire bijnierinsufficiëntie, secundaire bijnierschorsinsufficiëntie.
m Waaronder meldingen van hypofysitis, hypopituïtarisme, secundaire bijnierschorsinsufficiëntie, temperatuurregulatie-aandoening.
n Waaronder meldingen van hypomagnesiëmie, verlaagd magnesium in het bloed.
o Waaronder meldingen van perifere neuropathie, auto-immuunneuropathie, perifere sensorische neuropathie, polyneuropathie, herpes zoster, perifere motorische neuropathie, neuralgische amyotrofie, perifere sensomotorische neuropathie, toxische neuropathie, axonale neuropathie, lumbosacrale plexopathie, neuropathische artropathie, perifere-zenuwinfectie, neuritis, immuungemedieerde neuropathie.
p Waaronder meldingen van het syndroom van Guillain‑Barré, opstijgende slappe verlamming, demyeliniserende polyneuropathie.
q Waaronder meldingen van encefalitis, auto-immuunencefalitis, meningitis, meningitis aseptisch, fotofobie.
r Waaronder meldingen van myasthenia gravis.
s Waaronder meldingen van myocarditis, auto-immuunmyocarditis, immuungemedieerde myocarditis.
t Waaronder meldingen van pneumonitis, longinfiltratie, bronchiolitis, immuungemedieerde longziekte, immuungemedieerde pneumonitis, interstitiële longziekte, alveolitis, longopaciteit, longfibrose, longvergiftiging, bestralingspneumonitis.
u Waaronder meldingen van diarree, defecatie-urgentie, frequente darmbewegingen, maag-darmstelselhypermotiliteit.
v Waaronder meldingen van colitis, auto-immuuncolitis, ischemische colitis, microscopische colitis, ulceratieve colitis, omleidingscolitis, eosinofiele colitis, immuungemedieerde enterocolitis.
w Waaronder meldingen van orofaryngeale pijn, orofaryngeaal ongemak, keelirritatie.
x Waaronder meldingen van auto-immuunpancreatitis, pancreatitis, acute pancreatitis, verhoogd lipase, verhoogd amylase.
y Waaronder meldingen van ascites, auto-immuunhepatitis, hepatische cytolyse, hepatitis, acute hepatitis, toxische hepatitis, hepatotoxiciteit, immuungemedieerde hepatitis, leveraandoening, geneesmiddelgeïnduceerde leverbeschadiging, leverfalen, leversteatose, hepatische laesie, leverletsel, oesofageale varicesbloedingen, oesofageale varices, spontane bacteriële peritonitis.
z Waaronder meldingen van acne, blaar, dermatitis, acneïforme dermatitis, allergische dermatitis, geneesmiddeleruptie, eczeem, geïnfecteerd eczeem, erytheem, erytheem van het ooglid, ooglid uitslag, fixed eruption, folliculitis, steenpuist, dermatitis van de hand, immuungemedieerde dermatitis, lipblaar, bloedblaar in de mond, palmoplantair erytrodysesthesiesyndroom, pemfigoïd, uitslag, erythemateuze uitslag, maculeuze uitslag, maculopapuleuze uitslag, rash morbilliform, papuleuze uitslag, papulosquameuze uitslag, pruritische uitslag, pustulaire uitslag, vesiculaire uitslag, scrotum dermatitis, seborroïsche dermatitis, huidexfoliatie, huidtoxiciteit, huidzweer, uitslag op vaattoegangsplaats.
aa Waaronder meldingen van musculoskeletale pijn, myalgie, botpijn.
ab Waaronder meldingen van myositis, rabdomyolyse, polymyalgia rheumatica, dermatomyositis, spier-abces, aanwezigheid van myoglobine in de urine, myopathie, polymyositis.
ac Waaronder meldingen van proteïnurie, aanwezigheid van proteïne in urine, hemoglobinurie, urineafwijking, nefrotisch syndroom, albuminurie.
ad Waaronder meldingen van nefritis, auto-immuunnefritis, Henoch-Schonlein purpura-nefritis, paraneoplastische glomerulonefritis, tubulo-interstitiële nefritis.
ae Waaronder meldingen van hypokaliëmie, verlaagd kalium in het bloed.
af Waaronder meldingen van hyponatriëmie, verlaagd natrium in het bloed.
ag Waaronder meldingen van hypoxie, verlaagde zuurstofsaturatie, verlaagde pO2.
ah Waaronder meldingen van alopecia, madarose, alopecia areata, alopecia totalis, hypertrichose.
ai Waaronder meldingen van hypertensie, verhoogde bloeddruk, hypertensieve crisis, verhoogde systolische bloeddruk, diastolische hypertensie, inadequaat beheerste bloeddruk, hypertensieve retinopathie, hypertensieve nefropathie, essentiële hypertensie, orthostatische hypertensie.
aj Waaronder meldingen van sepsis, septische shock, urosepsis, neutropenische sepsis, long sepsis, bacteriële sepsis, Klebsiella-sepsis, abdominale sepsis, Candida-sepsis, Escherichia-sepsis, Pseudomonas-sepsis, stafylokokkensepsis.
ak Waaronder meldingen van bulleuze dermatitis, exfoliatieve uitslag, erythema multiforme, exfoliatieve dermatitis, gegeneraliseerde exfoliatieve dermatitis, toxische huideruptie, stevens-johnson-syndroom, geneesmiddelenreactie met eosinofilie en systemische symptomen, toxische epidermale necrolyse, cutane vasculitis.
al Waaronder meldingen van niet-infectieuze cystitis en immuungemedieerde cystitis.
am Waaronder meldingen van nasofaryngitis, verstopte neus en rhinorroe.
an Waaronder meldingen van psoriasis, dermatitis psoriasiformis.
ao Waaronder meldingen van pericarditis, pericardeffusie, harttamponade en pericarditisconstrictie.
ap Waaronder meldingen van droge huid, xerose.
aq Waaronder meldingen van lichenoïde keratose, lichen sclerosus en lichen planus.
ar Waaronder meldingen van sarcoïdose, longsarcoïdose en sarcoïdose van de lymfeklier.
as Waaronder meldingen van uveïtis, iridocyclitis en iritis.
at Waaronder meldingen van artritis, gewrichtszwelling, osteoartritis, reumatoïde artritis, polyartritis, spinale osteoartritis, auto-immuunartritis, immuungemedieerde artritis, spondylitis, vochtophoping in gewricht, artropathie, oligoartritis, reumatische aandoening.
au Waaronder meldingen van peesontsteking, peespijn, tenosynovitis en synovitis.
Beschrijving van geselecteerde bijwerkingen
De onderstaande gegevens geven informatie over significante bijwerkingen van atezolizumab als monotherapie in klinische onderzoeken (zie rubriek 5.1). Details over de significante bijwerkingen van atezolizumab, wanneer dit gegeven wordt in combinatie, zijn weergegeven indien klinisch relevante verschillen zijn waargenomen ten opzichte van atezolizumab-monotherapie. De behandelrichtlijnen voor deze bijwerkingen staan beschreven in rubrieken 4.2 en 4.4.
Immuungemedieerde pneumonitis
Pneumonitis trad op bij 3,0% (151/5.039) van de patiënten die atezolizumab als monotherapie kregen. Van deze patiënten hadden drie patiënten fatale voorvallen. De mediane tijd tot ontstaan was 3,7 maanden (bereik: 3 dagen tot 29,8 maanden). De mediane duur was 1,7 maanden (bereik: 0 dagen tot 27,8+ maanden; + geeft een gecensureerde waarde weer). Pneumonitis leidde tot stopzetting van atezolizumab bij 41 (0,8%) patiënten. Pneumonitis waarvoor het gebruik van corticosteroïden nodig was, trad op bij 1,8% (92/5.039) van de patiënten die atezolizumab-monotherapie kregen.
Immuungemedieerde hepatitis
Hepatitis trad op bij 1,7% (88/5.039) van de patiënten die atezolizumab als monotherapie kregen. Van de 88 patiënten hadden drie patiënten fatale voorvallen. De mediane tijd tot ontstaan was 1,4 maanden (bereik: 0 dagen tot 26,3 maanden). De mediane duur was 1 maand (bereik: 0 dagen tot 52,1+ maanden; + geeft een gecensureerde waarde weer). Hepatitis leidde tot stopzetting van atezolizumab bij 46 (0,9%) patiënten. Hepatitis waarvoor het gebruik van corticosteroïden nodig was, trad op bij 2,6% (130/5.039) van de patiënten die atezolizumab-monotherapie kregen.
Immuungemedieerde colitis
Colitis trad op bij 1,2% (62/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 4,5 maanden (bereik: 15 dagen tot 36,4 maanden). De mediane duur was 1,4 maanden (bereik: 3 dagen tot 50,2+ maanden; + geeft een gecensureerde waarde weer). Colitis leidde tot stopzetting van atezolizumab bij 24 (0,5%) patiënten. Colitis waarvoor het gebruik van corticosteroïden nodig was, trad op bij 0,6% (30/5.039) van de patiënten die atezolizumab-monotherapie kregen.
Immuungemedieerde endocrinopathieën
Schildklieraandoeningen
Hypothyreoïdie trad op bij 8,5% (427/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 4,2 maanden (bereik: 0 dagen tot 38,5 maanden). Hypothyreoïdie trad op bij 17,4% (86/495) van de patiënten die monotherapie met atezolizumab kregen in de adjuvante NSCLC-setting. De mediane tijd tot aanvang was 4,0 maanden (bereik: 22 dagen tot 11,8 maanden).
Hyperthyreoïdie trad op bij 2,4% (121/5.039) van de patiënten die atezolizumab-monotherapie kregen. De mediane tijd tot ontstaan was 2,7 maanden (bereik: 0 dagen tot 24,3 maanden). Hyperthyreoïdie trad op bij 6,5% (32/495) van de patiënten die atezolizumab als monotherapie kregen in de adjuvante NSCLC-setting. De mediane tijd tot aanvang was 2,8 maanden (bereik: 1 dag tot 9,9 maanden).
Bijnierinsufficiëntie
Bijnierinsufficiëntie trad op bij 0,5% (25/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 6,2 maanden (bereik: 3 dagen tot 21,4 maanden). Bijnierinsufficiëntie leidde tot stopzetting van atezolizumab bij 5 (0,1%) patiënten. Bijnierinsufficiëntie waarvoor het gebruik van corticosteroïden nodig was, trad op bij 0,4% (20/5.039) van de patiënten die atezolizumab-monotherapie kregen.
Hypofysitis
Hypofysitis trad op bij 0,2% (9/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 5,3 maanden (bereik: 21 dagen tot 13,7 maanden). Zes (0,1%) patiënten hadden corticosteroïden nodig en 1 (< 0,1%) patiënt stopte met de atezolizumab-behandeling.
Hypofysitis trad op bij 1,4% (15/1.093) van de patiënten die atezolizumab in combinatie met paclitaxel kregen gevolgd door atezolizumab, dose-dense (dat wil zeggen met verkorte intervallen tussen kuren) doxorubicine of epirubicine, en cyclofosfamide. De mediane tijd tot ontstaan was 3,8 maanden (bereik: 2,4 tot 10,7 maanden). Elf patiënten (1,0%) hadden corticosteroïden nodig en 7 (0,6%) patiënten stopten met de atezolizumab-behandeling.
Hypofysitis trad op bij 0,8% (3/393) van de patiënten die atezolizumab met bevacizumab, paclitaxel en carboplatine kregen. De mediane tijd tot ontstaan was 7,7 maanden (bereik: 5,0 tot 8,8 maanden). Twee patiënten moesten corticosteroïden gebruiken.
Hypofysitis trad op bij 0,4% (2/473) van de patiënten die atezolizumab in combinatie met nab-paclitaxel en carboplatine kregen. De mediane tijd tot ontstaan was 5,2 maanden (bereik: 5,1 tot 5,3 maanden). Beide patiënten moesten corticosteroïden gebruiken.
Diabetes mellitus
Diabetes mellitus trad op bij 0,6% (30/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 5,5 maanden (bereik: 3 dagen tot 29,0 maanden). Diabetes mellitus leidde tot stopzetting van atezolizumab bij < 0,1% (3/5.039) van de patiënten. Vier patiënten (< 0,1%) moesten corticosteroïden gebruiken.
Diabetes mellitus trad op bij 2,0% (10/493) van de HCC-patiënten die atezolizumab in combinatie met bevacizumab kregen. De mediane tijd tot ontstaan was 4,4 maanden (bereik: 1,2 maanden tot 8,3 maanden). Diabetes mellitus leidde niet tot stopzetting van atezolizumab.
Immuungemedieerde meningo-encefalitis
Meningo-encefalitis trad op bij 0,4% (22/5.039) van de patiënten die atezolizumab-monotherapie kregen. De mediane tijd tot ontstaan was 15 dagen (bereik: 0 dagen tot 12,5 maanden). De mediane duur was 24 dagen (bereik: 6 dagen tot 14,5+ maanden; + geeft een gecensureerde waarde weer).
Meningo-encefalitis waarvoor het gebruik van corticosteroïden nodig was, trad op bij 0,2% (12/5.039) van de patiënten die atezolizumab kregen en 8 patiënten (0,2%) stopten het gebruik van atezolizumab.
Immuungemedieerde neuropathieën
Het syndroom van Guillain‑Barré en demyeliniserende polyneuropathie
Het syndroom van Guillain‑Barré en demyeliniserende polyneuropathie, trad op bij 0,1% (6/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 4,1 maanden (bereik: 18 dagen tot 8,1 maanden). De mediane duur was 8,0 maanden (bereik: 18 dagen tot 24,5+ maanden; + geeft een gecensureerde waarde weer). Het syndroom van Guillain‑Barré leidde tot stopzetting van atezolizumab bij 1 patiënt (< 0,1%). Het syndroom van Guillain‑Barré waarvoor het gebruik van corticosteroïden nodig was, trad op bij < 0,1% (3/5.039) van de patiënten die atezolizumab-monotherapie kregen.
Immuungemedieerde gelaatsparese
Gelaatsparese trad op bij < 0,1% (1/5.039) van de patiënten die atezolizumab als monotherapie kregen. De tijd tot ontstaan was 29 dagen. De duur was 1,1 maand. Het voorval vereiste geen gebruik van corticosteroïden en het voorval leidde niet tot stopzetting van atezolizumab.
Immuungemedieerde myelitis
Myelitis trad op bij < 0,1 % (1/5.039) van de patiënten die atezolizumab als monotherapie kregen. De tijd tot ontstaan was 3 dagen. Het voorval vereiste het gebruik van corticosteroïden, maar leidde niet tot stopzetting van atezolizumab.
Myastheen syndroom
Myasthenia gravis trad op bij < 0,1% (2/5.039) van de patiënten (waaronder 1 fataal geval) die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 2,6 maanden (bereik: 1,2 maanden tot 4 maanden).
Immuungemedieerde pancreatitis
Pancreatitis, waaronder verhoogd amylase en verhoogd lipase, trad op bij 0,8% (40/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 5 maanden (bereik: 0 dagen tot 24,8 maanden). De mediane duur was 24 dagen (bereik: 3 dagen tot 40,4+ maanden; + geeft een gecensureerde waarde weer). Pancreatitis leidde tot stopzetting van atezolizumab bij 3 (< 0,1%) patiënten. Pancreatitis waarvoor het gebruik van corticosteroïden nodig was, trad op bij 0,2% (8/5.039) van de patiënten die atezolizumab-monotherapie kregen.
Immuungemedieerde myocarditis
Myocarditis trad op bij < 0,1% (5/5.039) van de patiënten die atezolizumab als monotherapie kregen. In de adjuvante NSCLC-setting had 1 van de 5 patiënten een fataal voorval. De mediane tijd tot ontstaan was 3,7 maanden (bereik: 1,5 tot 4,9 maanden). De mediane duur was 14 dagen (bereik: 12 dagen tot 2,8 maanden). Myocarditis leidde tot stopzetting van atezolizumab bij 3 patiënten (< 0,1%). Drie patiënten (< 0,1%) hadden corticosteroïden nodig.
Immuungemedieerde nefritis
Nefritis trad op bij 0,2% (11/5.039) van de patiënten die atezolizumab kregen. De mediane tijd tot ontstaan was 5,1 maanden (bereik: 3 dagen tot 17,5 maanden). Nefritis leidde tot stopzetting van atezolizumab bij 5 patiënten (≤ 0,1%). Vijf patiënten (0,1%) hadden corticosteroïden nodig.
Immuungemedieerde myositis
Myositis trad op bij 0,6% (32/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 3,5 maanden (bereik: 12 dagen tot 11,5 maanden). De mediane duur was 3,2 maanden (bereik: 9 dagen tot 51,1+ maanden; + geeft een gecensureerde waarde weer). Myositis leidde tot stopzetting van atezolizumab bij 6 patiënten (0,1%). Tien patiënten (0,2%) hadden corticosteroïden nodig.
Immuungemedieerde ernstige huidgerelateerde bijwerkingen (SCAR’s)
SCAR’s traden op bij 0,6% (30/5.039) van de patiënten die atezolizumab als monotherapie kregen. Van de 30 patiënten had één patiënt een fataal voorval. De mediane tijd tot ontstaan was 4,8 maanden (bereik: 3 dagen tot 15,5 maanden). De mediane duur was 2,4 maanden (bereik: 1 dag tot 37,5+ maanden; + geeft een gecensureerde waarde weer). SCAR’s leidden tot stopzetting van atezolizumab bij 3 patiënten (< 0,1%). SCAR’s waarbij systemische corticosteroïden nodig waren traden op bij 0,2% (9/5.039) van de patiënten die atezolizumab als monotherapie kregen.
Immuungemedieerde pericardaandoeningen
Pericardaandoeningen traden op bij 1% (49/5.039) van de patiënten die atezolizumab als monotherapie kregen. De mediane tijd tot ontstaan was 1,4 maanden (bereik: 6 dagen tot 17,5 maanden). De mediane duur was 2,5 maanden (bereik: 0 tot 51,5+ maanden; + geeft een gecensureerde waarde weer). Pericardaandoeningen leidden tot stopzetting van Tecentriq bij 3 patiënten (< 0,1%). Pericardaandoeningen waarbij behandeling met corticosteroïden nodig was, traden op bij 0,2% (7/5.039) van de patiënten.
Klasse-effecten van immuuncheckpointremmers
Tijdens behandeling met andere immuuncheckpointremmers zijn gevallen gemeld van de volgende bijwerking(en), die ook kan (kunnen) optreden tijdens behandeling met atezolizumab: pancreatische exocriene insufficiëntie.
Immunogeniteit
In de verschillende fase II- en III-onderzoeken ontwikkelden 13,1% tot 54,1% van de patiënten tijdens de behandeling ontstane antilichamen (ADA’s). Patiënten die ADA’s ontwikkelden, hadden over het algemeen ongunstigere gezondheids- en ziektekenmerken op baseline. Deze onevenwichtigheid in de gezondheids- en ziektekenmerken op baseline kan de interpretatie van PK-, werkzaamheids- en veiligheidsanalyses verstoren. Exploratieve analyses, waarbij is gecorrigeerd voor de onevenwichtige gezondheids- en ziektekenmerken op baseline zijn uitgevoerd om het effect van ADA op de werkzaamheid te bepalen. Deze analyses sloten mogelijke vermindering van de werkzaamheid bij patiënten die ADA ontwikkelden ten opzichte van patiënten die geen ADA ontwikkelden niet uit. De mediane tijd tot ontstaan van ADA varieerde van 3 tot 5 weken.
In de verschillende gepoolde gegevens van patiënten die behandeld zijn met atezolizumab-monotherapie (n = 3.460) en met combinatietherapieën (n = 2.285) zijn respectievelijk de volgende percentages bijwerkingen gezien in de ADA-positieve populatie vergeleken met de ADA-negatieve populatie: graad 3-4 bijwerkingen 46,2% versus 39,4%, ernstige bijwerkingen 39,6% versus 33,3%, bijwerkingen die leidden tot staken van de behandeling 8,5% versus 7,8% (monotherapie); graad 3-4 bijwerkingen 63,9% versus 60,9%, ernstige bijwerkingen 43,9% versus 35,6%, bijwerkingen die leidden tot staken van de behandeling 22,8% versus 18,4% (combinatietherapie). Uit de beschikbare gegevens kunnen echter geen definitieve conclusies getrokken worden over eventuele patronen van bijwerkingen.
Pediatrische patiënten
De veiligheid van atezolizumab bij kinderen en adolescenten is niet vastgesteld. In een klinisch onderzoek met 69 pediatrische patiënten (< 18 jaar oud) zijn geen nieuwe veiligheidssignalen waargenomen en het veiligheidsprofiel was vergelijkbaar met dat bij volwassenen.
Ouderen
Er zijn geen verschillen in veiligheid waargenomen tussen patiënten < 65 jaar, in de leeftijd 65-74 jaar en in de leeftijd 75-84 jaar die behandeld werden met atezolizumab-monotherapie. De gegevens van patiënten ≥ 85 jaar zijn te beperkt om conclusies te kunnen trekken over deze populatie.
Bij patiënten die atezolizumab in combinatie met bevacizumab, carboplatine en paclitaxel kregen in onderzoek IMpower150, werd een leeftijd ≥ 65 geassocieerd met een verhoogd risico op het ontwikkelen van bijwerkingen. In de onderzoeken IMpower150, IMpower133 en IMpower110 waren te weinig gegevens van patiënten ≥ 75 jaar om conclusies over deze populatie te kunnen trekken. Bij patiënten met NSCLC die niet in aanmerking kwamen voor platina-bevattende behandeling in de eerste lijn in het IPSOS-onderzoek waren geen verschillen in de veiligheidsprofielen tussen de leeftijdssubgroepen van de patiënten die eerstelijns atezolizumab als monotherapie kregen waargenomen.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMERS VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/17/1220/001
EU/1/17/1220/002
10. DATUM VAN HERZIENING VAN DE TEKST
16 oktober 2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3519006 | TECENTRIQ 1200MG CONC VOOR OPL VOOR INF FL 1X20ML | L01FF05 | - | € 4799,2 | Ja | - | - |
| 3983582 | TECENTRIQ 840MG CONC VOOR OPL VOOR INF FL 1X14ML | L01FF05 | - | € 3199,47 | Ja | - | - |