RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
1. DÉNOMINATION DU MÉDICAMENT
Evrysdi 0,75 mg/mL poudre pour solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient 60 mg de risdiplam dans 2 g de poudre pour solution buvable.
Chaque mL de la solution reconstituée contient 0,75 mg de risdiplam.
Excipients à effet notoire :
Chaque mL contient 0,38 mg de benzoate de sodium (E 211) et 2,97 mg d’isomalt (E 953).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour solution buvable. Poudre jaune clair, jaune, jaune grisâtre, jaune verdâtre ou vert clair.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
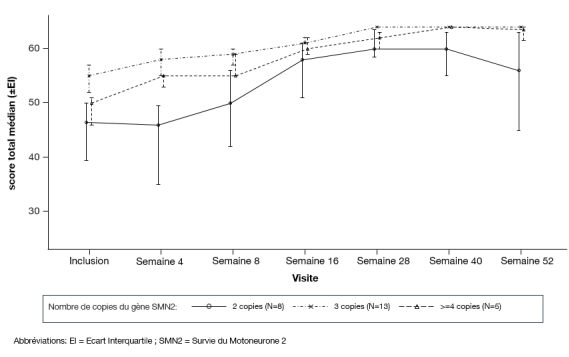
Evrysdi est indiqué dans le traitement de l’amyotrophie spinale (SMA) 5q chez les patients avec un diagnostic clinique de SMA de Type 1, Type 2 ou Type 3 ou avec une à quatre copies du gène SMN2.
4.2 Posologie et mode d’administration
Le traitement par Evrysdi doit être instauré par un médecin expérimenté dans la prise en charge de la SMA.
Posologie
La dose quotidienne recommandée d’Evrysdi est déterminée en fonction de l’âge et du poids corporel (voir Tableau 1). Evrysdi doit être pris par voie orale une fois par jour après un repas, à l’horaire habituel chaque jour.
Tableau 1 Schéma posologique en fonction de l’âge et du poids corporel
Âge* et poids corporel | Dose quotidienne recommandée |
< 2 mois | 0,15 mg/kg |
2 mois à < 2 ans | 0,20 mg/kg |
≥ 2 ans (< 20 kg) | 0,25 mg/kg |
≥ 2 ans (≥ 20 kg) | 5 mg |
* basé sur l’âge corrigé pour les nourrissons prématurés
Une dose quotidienne du traitement supérieure à 5 mg n’a pas été étudiée.
Doses retardées ou oubliées
En cas d’oubli d’une dose prévue, celle-ci doit être administrée le plus tôt possible dans les 6 heures suivant la dose initialement prévue. Si ce délai est dépassé, la dose oubliée ne doit pas être prise et reportée à l’horaire prévu le jour suivant.
Si la totalité de la dose n’est pas avalée ou si des vomissements surviennent après la prise, il ne faut pas administrer une nouvelle dose pour compenser. La dose suivante doit être administrée à l’horaire prévu le lendemain.
Personnes âgées
Aucun ajustement posologique n’est nécessaire chez les patients âgés sur la base de données limitées chez des sujets de 65 ans et plus (voir rubrique 5.2).
Insuffisance rénale
Risdiplam n’a pas été étudié dans cette population. Aucun ajustement posologique ne devrait être nécessaire chez les patients atteints d’insuffisance rénale (voir rubrique 5.2).
Insuffisance hépatique
Aucun ajustement posologique n’est nécessaire chez les patients atteints d’insuffisance hépatique légère ou modérée. Les patients atteints d’insuffisance hépatique sévère n’ont pas été étudiés et ils peuvent présenter une augmentation de l’exposition au risdiplam (voir rubriques 5.1 et 5.2).
Population pédiatrique
L’utilisation d’Evrysdi chez les patients atteints de SMA âgés de 2 mois ou moins est soutenue par des données pharmacocinétiques et de sécurité provenant de patients pédiatriques âgés de 16 jours ou plus (voir rubriques 4.8, 5.1 et 5.2). Aucune donnée sur la pharmacocinétique du risdiplam n’est disponible chez les nouveau-nés âgés de moins de 16 jours.
Mode d’administration
Voie orale.
Evrysdi doit être reconstitué par un professionnel de santé (par exemple : pharmacien) avant d’être dispensé.
Il est recommandé qu’un professionnel de santé discute avec le patient ou l’aidant de la façon de préparer la dose quotidienne prescrite avant la toute première administration.
Evrysdi est pris une fois par jour par voie orale après un repas, à l’horaire habituel, à l’aide de la seringue orale réutilisable fournie. Chez les nourrissons allaités, Evrysdi doit être administré après l’allaitement. Evrysdi ne doit pas être mélangé avec du lait ou du lait maternisé.
Evrysdi doit être pris immédiatement après avoir été prélevé dans la seringue orale. S’il n’est pas pris dans les 5 minutes, le produit doit être jeté et une nouvelle dose doit être préparée. Si Evrysdi se déverse ou est en contact avec la peau, la zone doit être lavée avec du savon et de l’eau.
Le patient doit boire de l’eau après avoir pris Evrysdi pour s’assurer que le médicament a été complètement avalé. Si le patient est incapable d’avaler et a une sonde nasogastrique ou de gastrostomie in situ, Evrysdi peut être administré par la sonde. La sonde doit être rincée à l’eau après l’administration d’Evrysdi.
Choix de la seringue orale pour la dose quotidienne prescrite :
Taille de la seringue | Volume correspondant à la dose | Graduations de la seringue |
1 mL | 0,3 mL à 1 mL | 0,01 mL |
6 mL | 1 mL à 6 mL | 0,1 mL |
12 mL | 6,2 mL à 6,6 mL | 0,2 mL |
Pour le calcul du volume correspondant à la dose, il est nécessaire de tenir compte des graduations de la seringue. Le volume correspondant à la dose doit être arrondi à la graduation la plus proche indiquée sur la seringue orale sélectionnée.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
Chez les patients atteints de SMA infantile, les effets indésirables les plus fréquents observés dans les études cliniques avec Evrysdi étaient la fièvre (54,8%), les éruptions cutanées (29,0%) et de la diarrhée (19,4%).
Chez les patients atteints de SMA d’apparition tardive, les effets indésirables les plus fréquents observés dans les études cliniques avec Evrysdi étaient la fièvre (21,7%), les maux de tête (20,0%), de la diarrhée (16,7%) et les éruptions cutanées (16,7%).
Les effets indésirables listés ci-dessus sont survenus sans profil clinique ou temporel identifiable et se sont généralement résolus malgré la poursuite du traitement chez les patients atteints de SMA infantile et d’apparition tardive.
Sur la base de l’analyse principale de RAINBOWFISH, le profil de sécurité d’Evrysdi des patients pré-symptomatiques est cohérent avec le profil de sécurité des patients symptomatiques atteints de SMA infantile et d’apparition tardive. L’étude RAINBOWFISH a inclus 26 patients atteints de SMA pré-symptomatique âgés de 16 à 41 jours au moment de la première dose (poids compris entre 3,1 et 5,7 kg). La durée médiane d'exposition était de 20,4 mois (intervalle : 10,6 à 41,9 mois). Les données post-commercialisation disponibles chez les nouveau-nés âgés de moins de 20 jours sont limitées.
Voir également rubrique 5.3 pour les effets d’Evrysdi observés dans les études non-cliniques.
Liste des effets indésirables sous forme de tableau
La catégorie de fréquence correspondante pour chaque effet indésirable est basée sur la convention suivante : très fréquent (≥1/10), fréquent (≥1/100, <1/10), peu fréquent (≥1/1 000, <1/100), rare (≥1/10 000, <1/1 000), très rare (<1/10 000). Les effets indésirables issus des études cliniques (Tableau 2) sont listés par classe de systèmes d’organes MedDRA.
Tableau 2 Effets indésirables survenant chez des patients atteints de SMA infantile et d’apparition tardive sur la base des études cliniques avec Evrysdi
Classe de système d’organes | SMA infantile (Type 1) | SMA d’apparition tardive (Type 2 et 3) |
Affections gastro-intestinales | ||
Diarrhée | Très fréquent | Très fréquent |
Nausées | Non applicable | Fréquent |
Ulcération buccale et ulcère aphteux | Fréquent | Fréquent |
Affections de la peau et du tissu sous-cutané | ||
Eruption cutanée* | Très fréquent | Très fréquent |
Affections du système nerveux | ||
Céphalées | Non applicable | Très fréquent |
Troubles généraux et anomalies au site d'administration | ||
Fièvre (incluant hyperpyréxie) | Très fréquent | Très fréquent |
Infections et infestations | ||
Infection des voies urinaires (incluant cystite) | Fréquent | Fréquent |
Affections musculo-squelettiques et systémiques | ||
Arthralgie | Non applicable | Fréquent |
* Inclut dermatites, dermatites acnéiformes, dermatites allergiques, érythèmes, folliculites, rash, rash érythémateux, rash maculo-papuleux, rash papuleux.
Profil de sécurité chez les patients précédemment traités par d’autres traitements de fond dans la SMA
Sur la base de l’analyse primaire de l’étude JEWELFISH, le profil de sécurité d’Evrysdi chez les patients atteints de SMA non naïfs de traitement ayant reçu Evrysdi pendant 59 mois (y compris ceux précédemment traités par le nusinersen [n = 76] ou par l’onasemnogene abeparvovec [n = 14]) est cohérent avec le profil de sécurité chez les patients atteints de SMA naïfs de traitement traités par Evrysdi dans les études FIREFISH, SUNFISH et RAINBOWFISH (voir rubrique 5.1).
Expérience post-commercialisation
Une vascularite cutanée a été rapportée au cours de l’expérience post-commercialisation. Les symptômes ont évolué favorablement après arrêt définitif d’Evrysdi. La fréquence ne peut être estimée sur la base des données disponibles.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir ci-dessous).
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen,
Allemagne
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/21/1531/001
10. DATE DE MISE À JOUR DU TEXTE
25 juillet 2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4342846 | EVRYSDI 0,75MG/ML PDR POUR SOL BUVABLE FL 1 X 60MG | M09AX10 | - | - | Oui | - | - |