RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Ocrevus 300 mg, solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient 300 mg d’ocrelizumab dans 10 mL à une concentration de 30 mg/mL. La concentration finale du médicament après dilution est d’environ 1,2 mg/mL.
Ocrelizumab est un anticorps monoclonal humanisé, produit dans des cellules d’ovaire de hamster chinois par la technologie de l’ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion.
Solution limpide à légèrement opalescente, incolore à marron pâle.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
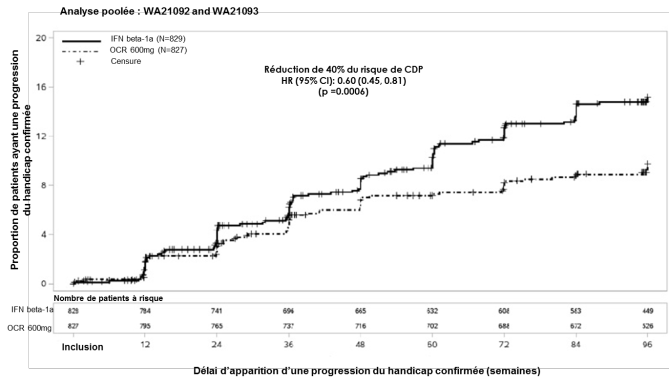
Ocrevus est indiqué dans le traitement des patients adultes atteints de formes actives de sclérose en plaques récurrente (SEP-R) définies par des paramètres cliniques ou d’imagerie (voir rubrique 5.1).
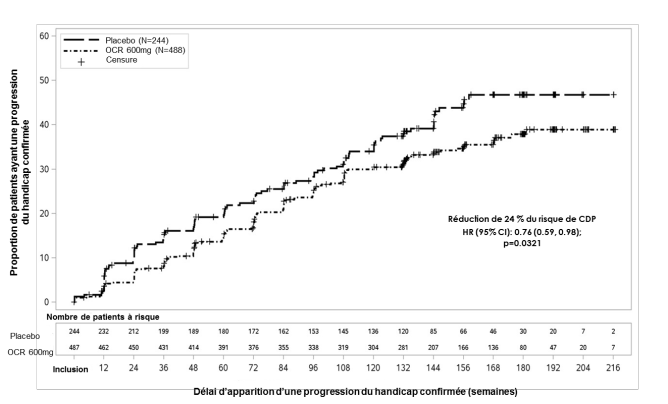
Ocrevus est indiqué dans le traitement des patients adultes atteints de sclérose en plaques primaire progressive (SEP-PP) à un stade précoce en termes de durée de la maladie et de niveau du handicap, associé à des données d’imagerie caractéristiques d’une activité inflammatoire (voir rubrique 5.1).
4.2 Posologie et mode d’administration
Le traitement doit être instauré et surveillé par des médecins spécialistes ayant l’expérience du diagnostic et du traitement des affections neurologiques et ayant accès au matériel nécessaire à la prise en charge des effets indésirables sévères tels que les réactions associées à la perfusion (RAP) graves.
Prémédication pour les réactions associées à la perfusion
Les deux prémédications suivantes doivent être administrées avant chaque perfusion d’ocrelizumab afin de réduire la fréquence et la sévérité des RAP (voir rubrique 4.4 pour les mesures additionnelles permettant de réduire les RAP) :
100 mg de méthylprednisolone par voie intraveineuse (ou un équivalent) environ 30 minutes avant chaque perfusion ;
antihistaminique environ 30 à 60 minutes avant chaque perfusion ;
De plus, une prémédication par un antipyrétique (par exemple, paracétamol) peut également être envisagée environ 30 à 60 minutes avant chaque perfusion.
Posologie
Dose initiale
La dose initiale de 600 mg est administrée en deux perfusions intraveineuses séparées ; une première perfusion de 300 mg, suivie 2 semaines plus tard d’une seconde perfusion de 300 mg (voir Tableau 1).
Doses suivantes
Les doses suivantes d’ocrelizumab sont administrées en perfusion intraveineuse unique de 600 mg tous les 6 mois (voir Tableau 1). La première des doses suivantes de 600 mg doit être administrée 6 mois après la première perfusion de la dose initiale.
Un intervalle minimal de 5 mois doit être maintenu entre chaque dose d’ocrelizumab.
Ajustements de la perfusion en cas de RAP
RAP engageant le pronostic vital
En cas de signes d’une RAP engageant le pronostic vital ou d’une RAP invalidante au cours d’une perfusion, telle qu’une réaction d’hypersensibilité aiguë ou un syndrome de détresse respiratoire aiguë, la perfusion doit être immédiatement arrêtée et le patient doit recevoir un traitement approprié. La perfusion doit être définitivement arrêtée chez ces patients (voir rubrique 4.3).
RAP sévères
Si un patient présente une RAP sévère (telle que dyspnée) ou un ensemble de symptômes comprenant bouffées vasomotrices, fièvre et douleur pharyngée, la perfusion doit être immédiatement interrompue, et le patient doit recevoir un traitement symptomatique. La perfusion ne sera reprise qu’après la résolution de tous les symptômes. La vitesse de perfusion initiale à la reprise du traitement doit être réduite de moitié par rapport à la vitesse de perfusion au moment de l’apparition de la réaction. Aucun ajustement de la perfusion n’est nécessaire pour les perfusions suivantes sauf si le patient présente une RAP.
RAP légères à modérées
Si un patient présente une RAP légère à modérée (par exemple céphalées), la vitesse de perfusion doit être réduite de moitié par rapport à la vitesse de perfusion lors de l’apparition de l’événement. Cette vitesse de perfusion réduite doit être maintenue pendant au moins 30 minutes. Si elle est tolérée, la vitesse de perfusion peut alors être augmentée conformément à la vitesse de perfusion initiale du patient. Aucun ajustement de la perfusion n’est nécessaire pour les perfusions suivantes sauf si le patient présente une RAP.
Modifications de la dose au cours du traitement
Les exemples ci-dessus d’interruption et de ralentissement de perfusion (pour les RAP légères à modérées et les RAP sévères) conduisent à un changement de la vitesse de perfusion et à une augmentation de la durée totale de perfusion, mais la dose totale n’est pas modifiée. Aucune réduction de dose n’est recommandée.
Doses retardées ou oubliées
Si une perfusion est oubliée, elle doit être administrée dès que possible ; ne pas attendre la dose planifiée suivante. L’intervalle de traitement de 6 mois (avec un minimum de 5 mois) doit être maintenu entre les doses (voir Tableau 1).
Populations particulières
Adultes de plus de 55 ans
Sur la base des données limitées disponibles (voir rubriques 5.1 et 5.2), aucun ajustement posologique n’est nécessaire chez les patients de plus de 55 ans. Les patients ayant participé aux études cliniques continuent de recevoir 600 mg d’ocrelizumab tous les six mois après avoir atteints l’âge de 55 ans.
Insuffisance rénale
La sécurité et l’efficacité d’ocrelizumab n’ont pas été formellement étudiées chez les patients présentant une insuffisance rénale. Des patients présentant une insuffisance rénale légère ont été inclus dans les études cliniques. Il n’y a pas d’expérience chez les patients présentant une insuffisance rénale modérée et sévère. Ocrelizumab est un anticorps monoclonal qui est éliminé par catabolisme (c’est-à-dire par dégradation en peptides et en acides aminés), et un ajustement de la dose ne devrait donc pas être nécessaire chez les patients présentant une insuffisance rénale (voir rubrique 5.2).
Insuffisance hépatique
La sécurité et l’efficacité d’ocrelizumab n’ont pas été formellement étudiées chez les patients présentant une insuffisance hépatique. Des patients présentant une insuffisance hépatique légère ont été inclus dans les études cliniques. Il n’y a pas d’expérience chez les patients présentant une insuffisance hépatique modérée et sévère. Ocrelizumab est un anticorps monoclonal qui est éliminé par catabolisme (plutôt que par métabolisme hépatique), et un ajustement de la dose ne devrait donc pas être nécessaire chez les patients présentant une insuffisance hépatique (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité d’ocrelizumab chez les enfants et adolescents âgés de 0 à 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Ocrevus 300 mg, solution à diluer pour perfusion n’est pas destiné à l’administration sous-cutanée et doit être administrée uniquement par perfusion intraveineuse.
Il est important de vérifier les informations présentes sur l’étiquette pour s’assurer que la forme médicamenteuse (intraveineuse ou sous-cutanée) administrée au patient soit bien celle prescrite.
Les patients peuvent commencer le traitement avec ocrelizumab par voie intraveineuse ou sous-cutanée.
Après dilution, le traitement est administré par perfusion intraveineuse réservée à ce seul produit. Les perfusions ne doivent pas être administrées en injection rapide ou en bolus.
Si les patients n’ont pas présenté de réaction associée à la perfusion (RAP) grave lors d’une précédente perfusion d’ocrelizumab, une perfusion plus rapide (2 heures) peut être réalisée pour les doses suivantes (voir Tableau 1, Option 2).
Tableau 1 : Dose et schéma d’administration
| Quantité d’ocrelizumab à administrer | Instructions relatives à la perfusion | |
Dose initiale | Perfusion 1 | 300 mg dans 250 mL | Débuter la perfusion à une vitesse de 30 mL/heure pendant 30 minutes |
Perfusion 2 | 300 mg dans 250 mL | ||
Doses suivantes | Option 1 | 600 mg dans 500 mL | Débuter la perfusion à une vitesse de 40 mL/heure pendant 30 minutes |
OU | |||
| Option 2 | 600 mg dans 500 mL | Débuter la perfusion à une vitesse de 100 mL/heure pendant les 15 premières minutes |
Les solutions pour perfusion intraveineuse sont préparées par dilution de la solution à diluer dans une poche de perfusion contenant du chlorure de sodium 9 mg/mL (0,9 %) en solution pour perfusion, jusqu’à une concentration finale d’ocrelizumab d’environ 1,2 mg/mL.
Pour des instructions concernant la dilution du médicament avant administration, voir la rubrique 6.6.
Les patients doivent être surveillés pendant la perfusion et pendant au moins 1 heure après la fin de la perfusion (voir rubrique 4.4).
4.3 Contre-indications
- Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Infection active en cours (voir rubrique 4.4).
Patients présentant un déficit immunitaire sévère (voir rubrique 4.4).
Affections malignes évolutives connues (voir rubrique 4.4).
4.8 Effets indésirables
Résumé du profil de sécurité
Pendant la période contrôlée des études cliniques pivots, les effets indésirables (EI) les plus importants et les plus fréquemment rapportés ont été les RAP (34,3 % ; 40,1 % dans la SEP-R et la SEP-PP respectivement) et les infections (58,5 % ; 72,2 % dans la SEP-R et la SEP-PP respectivement) (voir rubrique 4.4).
Au total, 2 376 patients ont été inclus durant la période contrôlée des études cliniques pivots ; parmi ces patients, 1 852 ont été inclus dans la phase d’extension en ouvert. Durant la phase d’extension en ouvert, tous les patients sont passés à un traitement par ocrelizumab. 1 155 patients ont terminé la phase d’extension en ouvert, conduisant au total à un recul d’environ 10 ans de traitement continu par ocrelizumab (exposition de 15 515 patients-années) durant la période contrôlée et la phase d’extension en ouvert. Le profil de sécurité global observé pendant la période contrôlée et la phase d’extension en ouvert reste conforme à celui observé durant la période contrôlée.
Liste tabulée des effets indésirables
Les effets indésirables rapportés durant la période contrôlée des études cliniques pivots et issus des notifications spontanées sont listés ci-dessous dans le Tableau 2. Les effets indésirables sont listés par classe de systèmes d’organes MedDRA et par catégories de fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles). Au sein de chaque classe de systèmes d’organes, les effets indésirables sont présentés par ordre décroissant de fréquence.
Tableau 2 : Effets indésirables
| Très fréquent | Fréquent | Fréquence indéterminée |
Infections et infestations | Infection des voies respiratoires supérieures, rhinopharyngite, grippe | Sinusite, |
|
Affections hématologiques et du système lymphatique |
| Neutropénie | Neutropénie tardive2 |
Affections respiratoires, thoraciques et médiastinales |
| Toux, |
|
Investigations | Diminution du taux sanguin d’immunoglobulines M | Diminution du taux sanguin d’immunoglobulines G |
|
Lésions, intoxications et complications liées aux procédures | Réactions associées à la perfusion1 |
|
|
1 Voir Descriptions des effets indésirables sélectionnés.
2 Observé après commercialisation.
Description des effets indésirables sélectionnés
Réactions associées à la perfusion
Dans les études de la SEP-R et de la SEP-PP, les symptômes associés à des RAP ont inclus, mais sans s’y limiter : prurit, rash, urticaire, érythème, bouffées vasomotrices, hypotension, fièvre, fatigue, céphalées, étourdissements, irritation de la gorge, douleur oro-pharyngée, dyspnée, œdème pharyngé ou laryngé, nausées, tachycardie. Dans les études contrôlées, il n’y a eu aucune RAP fatale. De plus, les symptômes des RAP après commercialisation comprenaient l’anaphylaxie.
Dans les études cliniques contrôlées versus un comparateur actif (SEP-R), les RAP ont été l’effet indésirable le plus fréquent dans le groupe de traitement par ocrelizumab avec une incidence globale de 34,3 % en comparaison à une incidence de 9,9 % dans le groupe de traitement par l’interféron bêta-1a (perfusion de placebo). L’incidence des RAP a été plus élevée pendant la perfusion 1 de la dose 1 (27,5 %) et a diminué avec le temps à < 10 % à la dose 4. La majorité des RAP dans les deux groupes de traitement a été légère à modérée. 21,7 % et 10,1 % des patients traités par ocrelizumab ont présenté des RAP respectivement légères et modérées. 2,4 % ont présenté des RAP sévères et 0,1 % ont présenté des RAP engageant le pronostic vital.
Dans l’étude clinique contrôlée versus placebo (SEP-PP), les RAP ont été l’effet indésirable le plus fréquent dans le groupe de traitement par ocrelizumab avec une incidence globale de 40,1 % en comparaison à une incidence de 25,5 % dans le groupe placebo. L’incidence des RAP a été plus élevée pendant la perfusion 1 de la dose 1 (27,4 %) et a diminué avec les doses suivantes à < 10 % à la dose 4. Dans chaque groupe, la proportion de patients ayant présenté des RAP était plus grande lors de la première perfusion de chaque dose que lors de la deuxième perfusion de cette dose. La majorité des RAP a été légère à modérée. 26,7 % et 11,9 % des patients traités par ocrelizumab ont présenté des RAP respectivement légères et modérées, 1,4 % ont présenté des RAP sévères. Il n’y a eu aucune RAP engageant le pronostic vital. Voir rubrique 4.4.
Au cours de la période contrôlée et de la phase d’extension en ouvert des études cliniques sur les SEP-R et SEP-PP, les patients ont reçu environ 20 doses d'ocrelizumab. L'incidence des RAP a diminué au-dessous de 4 % à la dose 4 de la phase d’extension en ouvert chez les patients atteints de SEP-R et au-dessous de 5 % à la dose 5 de la phase d’extension en ouvert chez les patients atteints de SEP-PP. Avec les doses suivantes administrées durant la phase d’extension en ouvert, l'incidence des RAP est restée faible. La majorité des RAP étaient d’intensité légère durant la phase d’extension en ouvert.
Perfusion plus rapide alternative pour les doses suivantes
Dans une étude (MA30143 Sous-étude perfusion plus rapide) conçue pour décrire le profil de sécurité de perfusions plus rapides (2 heures) d’ocrelizumab chez les patients atteints de sclérose en plaques récurrente-rémittente ; l’incidence, l’intensité, et le type de symptômes des RAP étaient conformes à ceux des perfusions administrées sur 3,5 heures (voir rubrique 5.1). Le nombre global d’interventions nécessaires était faible dans les deux groupes de perfusion ; cependant, plus d’interventions (ralentissements ou interruptions temporaires) ont été nécessaires pour prendre en charge les RAP dans le groupe de perfusion plus rapide (2 heures) en comparaison au groupe de perfusion de 3,5 heures (8,7% vs 4,8%, respectivement).
Infection
Dans les études contrôlées versus un comparateur actif dans la SEP-R, des infections sont survenues chez 58,5 % des patients ayant reçu ocrelizumab versus 52,5 % des patients ayant reçu l’interféron bêta-1a. Des infections graves sont survenues chez 1,3 % des patients ayant reçu ocrelizumab versus 2,9 % des patients recevant l’interféron bêta-1a. Dans l’étude contrôlée versus placebo dans la SEP-PP, des infections sont survenues chez 72,2 % des patients ayant reçu ocrelizumab versus 69,9 % des patients ayant reçu le placebo. Des infections graves sont survenues chez 6,2 % des patients ayant reçu ocrelizumab versus 6,7 % des patients ayant reçu le placebo.
Tous les patients sont passés à ocrelizumab durant la phase d’extension en ouvert dans les études SEP-R et SEP-PP. Au cours de la phase d’extension en ouvert chez les patients atteints de SEP-R et de SEP-PP, le risque global d'infections graves n'a pas augmenté par rapport à celui observé durant la période contrôlée. Comme observé durant la période contrôlée, le taux d'infections graves chez les patients atteints de SEP-PP est resté plus élevé que celui observé chez les patients atteints de SEP-R.
Conformément à l'analyse précédente relative aux facteurs de risque d'infections graves dans les maladies auto-immunes autres que la SEP (voir rubrique 4.4), une analyse multivariée des facteurs de risque d'infections graves a été conduite sur les données d'exposition cumulée recueillies pendant environ 10 ans à partir de la période contrôlée et la phase d’extension en ouvert des études cliniques pivots. Les facteurs de risque d'infections graves chez les patients atteints de SEP-R comprennent la présence d'au moins une comorbidité, une poussée clinique récente, et un score EDSS (Expanded Disability Status Scale - échelle d’évaluation du handicap) ≥ 6,0. Les facteurs de risque d'infections graves chez les patients atteints de SEP-PP comprennent un indice de masse corporelle supérieur à 25 kg/m2, la présence d'au moins deux comorbidités, un score EDSS ≥ 6,0, et des IgM < limite inférieure de la normale (LIN). Les comorbidités incluaient, sans y être limitées, les affections cardiovasculaires, rénales et des voies urinaires, les infections antérieures, et la dépression.
Infections des voies respiratoires
La proportion d’infections des voies respiratoires a été plus élevée chez les patients traités par ocrelizumab versus l’interféron bêta-1a et versus le placebo.
Dans les études cliniques dans la SEP-R, 39,9 % des patients traités par ocrelizumab et 33,2 % des patients traités par l’interféron bêta-1a ont présenté une infection des voies respiratoires supérieures et 7,5 % des patients traités par ocrelizumab et 5,2 % des patients traités par l’interféron bêta-1a ont présenté une infection des voies respiratoires inférieures.
Dans l’étude clinique dans la SEP-PP, 48,8 % des patients traités par ocrelizumab et 42,7 % des patients ayant reçu le placebo ont présenté une infection des voies respiratoires supérieures, et 9,9 % des patients traités par ocrelizumab et 9,2 % des patients ayant reçu le placebo ont présenté une infection des voies respiratoires inférieures.
Les infections des voies respiratoires rapportées chez les patients traités par ocrelizumab ont essentiellement été légères à modérées (80-90 %).
Herpès
Dans les études cliniques contrôlées versus un comparateur actif (SEP-R), les infections herpétiques ont été rapportées plus fréquemment chez les patients traités par ocrelizumab que chez les patients traités par interféron-bêta-1a, dont zona (2,1 % versus 1,0 %), herpès simplex (0,7 % versus 0,1 %), herpès buccal (3,0 % versus 2,2 %), herpès génital (0,1 % versus 0 %) et infection par le virus de l’herpès (0,1 % versus 0 %). Toutes les infections ont été légères à modérées, à l’exception d’un évènement de grade 3, et les patients ont guéri avec un traitement standard.
Dans l’étude clinique contrôlée versus placebo (SEP-PP), une proportion plus importante de patients avec un herpès buccal (2,7 % versus 0,8 %) a été observée dans le bras traité par ocrelizumab.
Anomalies biologiques
Immunoglobulines
Le traitement par ocrelizumab a entraîné une diminution des immunoglobulines totales au cours de la période contrôlée des études cliniques pivots, principalement due à une réduction des IgM.
Les données des études cliniques issues de la période contrôlée et de la phase d’extension en ouvert des études cliniques pivots ont montré une relation entre la réduction des taux des IgG (et dans une moindre mesure pour les IgM ou les IgA) et l’augmentation du taux d’infections graves. 2,1 % des patients atteints de SEP-R ont présenté une infection grave durant la phase avec des IgG < LIN et 2,3 % des patients atteints de SEP-PP ont présenté une infection grave durant la phase avec des IgG < LIN. La différence de taux d'infections graves entre les patients ayant des IgG < LIN comparé aux patients ayant des IgG ≥ LIN n'a pas augmenté au cours du temps. Le type, la sévérité, la latence, la durée et l’évolution des infections graves observés durant les phases d'immunoglobulines inférieures à la LIN étaient conformes aux infections graves observées chez les patients traités par ocrelizumab pendant la période contrôlée et la phase d’extension en ouvert. Tout au long des 10 années de traitement continu par ocrelizumab, les taux moyens d'IgG chez les patients atteints de SEP-R et SEP-PP sont restés au-dessus de la LIN.
Lymphocytes
Dans la SEP-R, une diminution des lymphocytes < LIN a été observée chez 20,7 % des patients traités par ocrelizumab versus 32,6 % des patients traités par l’interféron bêta-1a. Dans la SEP-PP, une diminution des lymphocytes < LIN a été observée chez 26,3 % des patients traités par ocrelizumab versus 11,7 % des patients traités par placebo.
La majorité de ces diminutions observées chez les patients traités par ocrelizumab étaient de sévérité de grade 1 (entre < LIN et 800 cellules/mm3) et de grade 2 (entre 500 et 800 cellules/mm3). Environ 1 % des patients du groupe ocrelizumab a présenté une lymphopénie de grade 3 (entre 200 et 500 cellules/mm3). Aucun de ces patients n’a présenté une lymphopénie de grade 4 (< 200 cellules/mm3).
Chez les patients traités par ocrelizumab, une augmentation du taux d’infections graves a été observée durant des périodes de diminution confirmée du nombre total de lymphocytes. Le nombre d’infections graves était trop faible pour établir une conclusion définitive.
Neutrophiles
Au cours de la période de traitement contrôlée versus un comparateur actif (SEP-R), une diminution des neutrophiles < LIN a été observée chez 14,7 % des patients traités par ocrelizumab versus 40,9 % des patients traités par l’interféron bêta-1a. Dans l’étude clinique contrôlée versus placebo (SEP-PP), la proportion de patients traités par ocrelizumab présentant une diminution des neutrophiles a été plus élevée (12,9 %) que chez les patients sous placebo (10,0 %) ; parmi ces patients, un pourcentage plus important de patients (4,3 %) dans le groupe ocrelizumab a présenté une neutropénie de grade 2 ou plus versus 1,3 % dans le groupe placebo ; environ 1 % des patients du groupe ocrelizumab a présenté une neutropénie de grade 4 versus 0 % dans le groupe placebo.
La majorité des cas de diminution des neutrophiles a été transitoire (observée une seule fois pour un patient donné traité par ocrelizumab) et de sévérité de grade 1 (entre < LIN et 1500 cellules/mm3) et 2 (entre 1000 et 1500 cellules/mm3). Globalement, approximativement 1 % des patients dans le groupe ocrelizumab ont eu une neutropénie de Grade 3 ou 4. Un patient avec une neutropénie de Grade 3 (entre 500 et 1000 cellules/mm3) et un patient avec une neutropénie de Grade 4 (< 500 cellules/mm3) ont eu besoin d’un traitement spécifique avec facteur de croissance granulocytaire, et ont continué à recevoir ocrelizumab après résolution de la neutropénie. Une neutropénie peut survenir plusieurs mois après l’administration d’ocrelizumab (voir rubrique 4.4).
Autre
Un patient, qui a reçu 2000 mg d’ocrelizumab, est décédé d’un syndrome de réponse inflammatoire systémique (SIRS) d’étiologie inconnue, suite à un examen IRM 12 semaines après la dernière perfusion ; une réaction anaphylactoïde à l’agent de contraste à base de gadolinium de l’IRM peut avoir contribué à ce SIRS.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir ci-dessous).
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/17/1231/001
EU/1/17/1231/002
10. DATE DE MISE À JOUR DU TEXTE
13 février 2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3519014 | OCREVUS 300MG SOL POUR PERF 30MG/ML FL INJ 1X10ML | L04AA36 | - | € 4470,85 | Oui | - | - |