RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Gazyvaro 1 000 mg solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon de 40 mL de solution à diluer contient 1 000 mg d'obinutuzumab correspondant à une concentration avant dilution de 25 mg/mL.
L'obinutuzumab est un anticorps monoclonal anti-CD20 humanisé de type II, appartenant à la sous-classe des IgG1, obtenu par humanisation de l'anticorps murin parental B-Ly1 et produit dans les cellules ovariennes de hamster chinois par la technologie de l’ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion.
Liquide limpide, incolore à légèrement brunâtre.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Leucémie lymphoïde chronique (LLC)
Gazyvaro est indiqué en association au chlorambucil pour le traitement des patients adultes atteints de LLC non précédemment traités, et présentant des comorbidités les rendant inéligibles à un traitement à base de fludarabine à pleine dose (voir rubrique 5.1).
Lymphome folliculaire (LF)
Gazyvaro associé à une chimiothérapie en induction, suivi d’un traitement d’entretien par Gazyvaro chez les patients répondeurs, est indiqué chez les patients atteints de LF avancé non précédemment traités (voir rubrique 5.1).
Gazyvaro associé à la bendamustine en induction, suivi d’un traitement d’entretien par Gazyvaro, est indiqué chez les patients atteints de LF en cas de non-réponse ou de progression, pendant ou dans les 6 mois suivant un traitement incluant du rituximab.
4.2 Posologie et mode d'administration
Gazyvaro doit être administré sous étroit contrôle d’un médecin expérimenté et dans un environnement où l’ensemble des moyens de réanimation est immédiatement disponible.
Posologie
Prophylaxie et prémédication du syndrome de lyse tumorale
Les patients ayant une masse tumorale importante et/ou un nombre élevé de lymphocytes circulants (> 25 x 109/l) et/ou une insuffisance rénale (ClCr < 70 mL/min) sont considérés à risque de syndrome de lyse tumorale et doivent recevoir un traitement prophylactique. Le traitement prophylactique doit consister en une hydratation appropriée et en l’administration d’uricostatiques (par exemple, allopurinol), ou d’une alternative thérapeutique appropriée telle qu’une urate oxydase (par exemple, rasburicase), démarrant 12 à 24 heures avant le début de la perfusion de Gazyvaro conformément à la pratique courante (voir rubrique 4.4). Les patients doivent continuer à recevoir un traitement prophylactique de façon répétée avant chaque perfusion ultérieure, si cela est jugé approprié.
Prophylaxie et prémédication pour les réactions liées à la perfusion
La prémédication à administrer afin de réduire le risque de réactions liées à la perfusion est mentionnée dans le tableau 1 (voir également rubrique 4.4). Une prémédication par corticoïdes est recommandée pour les patients atteints de LF et elle est obligatoire pour les patients atteints de LLC au cours du premier cycle (voir tableau 1). La prémédication pour les perfusions suivantes et les autres prémédications doivent être administrées comme décrit ci-dessous.
Une hypotension, l'un des symptômes de réactions liées à la perfusion, peut se produire au cours des perfusions intraveineuses de Gazyvaro. La suspension des traitements antihypertenseurs doit donc être envisagée 12 heures avant chaque perfusion de Gazyvaro, ainsi que pendant toute la durée de la perfusion et pendant la première heure suivant la fin de l'administration (voir rubrique 4.4).
Tableau 1 Prémédication à administrer avant la perfusion de Gazyvaro afin de réduire le risque de réactions liées à la perfusion chez les patients atteints de LLC et de LF (voir rubrique 4.4)
Jour du cycle de traitement | Patients nécessitant une prémédication | Prémédication | Administration |
Cycle 1 : | Tous les patients | Corticoïde intraveineux1,4 | Terminée au moins 1 heure avant la perfusion de Gazyvaro |
Analgésique/antipyrétique oral2 | Au moins 30 minutes avant la perfusion de Gazyvaro | ||
Antihistaminique3 | |||
Cycle 1 : | Tous les patients | Corticoïde intraveineux1 | Terminée au moins 1 heure avant la perfusion de Gazyvaro |
Analgésique/antipyrétique oral2 | Au moins 30 minutes avant la perfusion de Gazyvaro | ||
Antihistaminique3 | |||
Toutes les perfusions suivantes pour la LLC et le LF | Patients sans réaction liée à la perfusion lors de la perfusion précédente | Analgésique/antipyrétique oral2 | |
Patients ayant eu une réaction liée à la perfusion (grade 1 ou 2) lors de la perfusion précédente | Analgésique/antipyrétique oral2 | ||
Patients ayant eu une réaction liée à la perfusion de grade 3 lors de la perfusion précédente OU | Corticoïde intraveineux1,4 | Terminée au moins 1 heure avant la perfusion de Gazyvaro | |
Patients avec un nombre de lymphocytes > 25 x 109/l avant la prochaine administration | Analgésique/antipyrétique oral2 | Au moins 30 minutes avant la perfusion de Gazyvaro |
1100 mg de prednisone/prednisolone ou 20 mg de dexaméthasone ou 80 mg de méthylprednisolone. L'hydrocortisone ne doit pas être utilisée car elle n'est pas efficace pour réduire les taux de réactions liées à la perfusion.
2 par exemple, 1 000 mg de paracétamol
3 par exemple, 50 mg de diphénhydramine
4 Si un protocole de chimiothérapie contenant un corticoïde est administré le même jour que Gazyvaro, le corticoïde peut être administré par voie orale s’il est administré au moins 60 minutes avant Gazyvaro, auquel cas, une prémédication par un corticoïde IV supplémentaire n’est pas nécessaire.
Dose
Leucémie lymphoïde chronique (LLC, en association au chlorambucil1)
Pour les patients atteints de LLC, la dose recommandée de Gazyvaro en association au chlorambucil est présentée dans le tableau 2.
Cycle 1
La dose recommandée de Gazyvaro en association au chlorambucil est de 1 000 mg administrés sur J1 et J2 (ou J1 suite), et à J8 et J15 du premier cycle de traitement de 28 jours.
Deux poches de perfusion doivent être préparées pour la perfusion à J1 et J2 (100 mg à J1 et 900 mg à J2). Si la première poche a été entièrement perfusée sans modification de la vitesse de perfusion ni interruption de la perfusion, la seconde poche peut être administrée le même jour (report de dose inutile, et pas de nécessité de répéter la prémédication) à condition de disposer de suffisamment de temps, de réunir les conditions nécessaires et de pouvoir assurer une surveillance médicale pendant toute la durée de la perfusion. En cas de modification de la vitesse de perfusion ou d'interruption de la perfusion au cours de l'administration des 100 premiers mg, la seconde poche doit être administrée le lendemain.
Cycles 2 à 6
La dose recommandée de Gazyvaro en association au chlorambucil est de 1 000 mg administrés à J1 de chaque cycle de traitement.
Tableau 2 Dose de Gazyvaro à administrer pendant 6 cycles de traitement de 28 jours chacun pour les patients atteints de LLC
Cycle | Jour du traitement | Dose de Gazyvaro |
Cycle 1 | J1 | 100 mg |
J2 | 900 mg | |
J8 | 1 000 mg | |
J15 | 1 000 mg | |
Cycles 2 – 6 | J1 | 1 000 mg |
1Voir rubrique 5.1 pour des informations sur la dose de chlorambucil
Durée du traitement
Six cycles de traitement de 28 jours chacun.
Report ou omission d'une dose
Si une dose prévue de Gazyvaro est omise, elle doit être administrée dès que possible, sans attendre la dose suivante prévue. L'intervalle prévu entre les administrations de Gazyvaro doit être maintenu.
Lymphome folliculaire (LF)
Pour les patients atteints de LF, la dose recommandée de Gazyvaro en association à la chimiothérapie est présentée dans le tableau 3.
Patients atteints de lymphome folliculaire non précédemment traités
Induction (en association à la chimiothérapie2)
Gazyvaro doit être administré avec la chimiothérapie de la manière suivante :
Six cycles de 28 jours en association à la bendamustine2 ou,
Six cycles de 21 jours en association à cyclophosphamide, doxorubicine, vincristine, prednisolone (CHOP), suivis de 2 cycles supplémentaires de Gazyvaro seul ou,
Huit cycles de 21 jours en association à cyclophosphamide, vincristine et prednisone/ prednisolone/ méthylprednisolone (CVP).
Entretien
Les patients en réponse complète ou partielle après traitement d’induction par Gazyvaro en association à la chimiothérapie (CHOP ou CVP ou bendamustine) doivent continuer à recevoir Gazyvaro seul en traitement d’entretien, 1 000 mg tous les 2 mois jusqu’à progression de la maladie ou pendant une durée maximale de 2 ans.
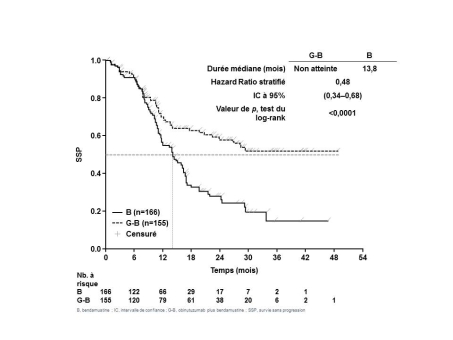
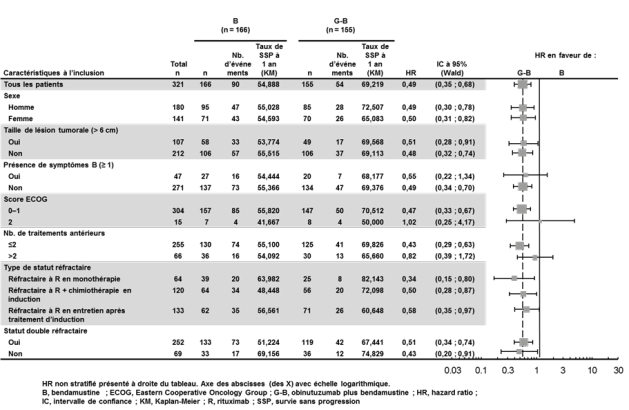
Patients atteints de lymphome folliculaire en cas de non-réponse ou de progression, pendant ou dans les 6 mois suivant un traitement incluant du rituximab.
Induction (en association à la bendamustine2)
Gazyvaro doit être administré en six cycles de 28 jours en association à la bendamustine2.
Entretien
Les patients en réponse complète ou partielle après le traitement d’induction par Gazyvaro en association à la bendamustine (c’est-à-dire 6 cycles de traitement initiaux) ou avec une maladie stable doivent continuer à recevoir Gazyvaro seul en traitement d’entretien, 1 000 mg tous les 2 mois jusqu’à progression de la maladie ou pendant une durée maximale de 2 ans.
Tableau 3 Lymphome folliculaire : Dose de Gazyvaro à administrer pendant le traitement d’induction, suivi du traitement d’entretien
Cycle | Jour du traitement | Dose de Gazyvaro |
Cycle 1 | J1 | 1 000 mg |
J8 | 1 000 mg | |
J15 | 1 000 mg | |
Cycles 2 – 6 ou 2–8 | J1 | 1 000 mg |
Entretien | Tous les 2 mois jusqu’à progression de la maladie ou pendant une durée maximale de 2 ans | 1 000 mg |
2Voir rubrique 5.1 pour des informations sur la dose de bendamustine
Durée du traitement
Traitement d’induction d’environ 6 mois (six cycles de traitement par Gazyvaro de 28 jours chacun, en cas d’association à la bendamustine, ou huit cycles de traitement par Gazyvaro de 21 jours chacun en cas d’association à CHOP ou CVP), suivi d’un traitement d’entretien une fois tous les 2 mois jusqu’à progression de la maladie ou pendant une durée maximale de 2 ans.
Report ou omission d'une dose
Si une injection prévue de Gazyvaro est omise, elle doit être administrée dès que possible, sans l’annuler ni attendre l’injection suivante prévue. En cas de survenue d’une toxicité au cours du Cycle 1 nécessitant un report des doses de J8 ou J15, ces doses doivent être administrées après la résolution de la toxicité. Dans ce cas, toutes les visites ultérieures et le début du Cycle 2 seront décalés pour tenir compte du retard survenu au cours du Cycle 1.
Pendant le traitement d’entretien, il est recommandé de maintenir le calendrier initial des injections.
Adaptations posologiques au cours du traitement (toutes indications)
Aucune réduction de dose de Gazyvaro n'est recommandée.
Pour la prise en charge des événements indésirables symptomatiques (y compris les réactions liées à la perfusion), voir paragraphe ci-dessous (Prise en charge des réactions liées à la perfusion, ou la rubrique 4.4).
Populations particulières
Patients âgés
Aucune adaptation posologique n'est nécessaire chez les patients âgés (voir rubrique 5.2).
Insuffisance rénale
Aucune adaptation posologique n'est nécessaire chez les patients atteints d'insuffisance rénale légère à modérée (clairance de la créatinine [ClCr] 30 à 89 mL/min) (voir rubrique 5.2). La sécurité et l'efficacité de Gazyvaro n'ont pas été établies chez les patients atteints d'insuffisance rénale sévère (ClCr < 30 mL/min) (voir rubriques 4.8 et 5.2).
Insuffisance hépatique
La sécurité et l'efficacité de Gazyvaro n'ont pas été établies chez les patients atteints d'insuffisance hépatique. Aucune recommandation posologique spécifique ne peut être faite.
Population pédiatrique
La sécurité et l'efficacité de Gazyvaro chez les enfants et les adolescents âgés de moins de 18 ans n'ont pas été établies. Aucune donnée n'est disponible.
Mode d'administration
Gazyvaro est à utiliser par voie intraveineuse. Après dilution (voir rubrique 6.6), la solution de Gazyvaro doit être administrée en perfusion intraveineuse réservée à ce seul produit. Elle ne doit pas être injectée rapidement ni en bolus.
Pour les instructions relatives à la dilution de Gazyvaro avant l'administration, voir rubrique 6.6.
Les instructions sur la vitesse de perfusion sont présentées dans les tableaux 4 à 6.
Leucémie lymphoïde chronique (LLC)
Tableau 4 Leucémie lymphoïde chronique : Vitesse de perfusion standard en l'absence de réactions liées à la perfusion/d'hypersensibilité et recommandations en cas de réaction liée à la perfusion lors de la perfusion précédente
Cycle | Jour du traitement | Vitesse de perfusion |
Cycle 1 | J1 | Administrer à une vitesse de 25 mg/h sur 4 heures. Ne pas augmenter la vitesse de perfusion. |
J2 | Sans réaction liée à la perfusion lors de la perfusion précédente, administrer à une vitesse de 50 mg/h. | |
J8 | Sans réaction liée à la perfusion lors de la perfusion précédente, lorsque la vitesse finale de la perfusion était ≥ 100 mg/h, les perfusions peuvent être débutées à une vitesse de 100 mg/h et augmentées par paliers de 100 mg/h toutes les 30 minutes jusqu'à un maximum de 400 mg/h. | |
J15 | ||
Cycles 2 – 6 | J1 |
Lymphome folliculaire (LF)
Gazyvaro doit être administré à la vitesse de perfusion standard au cours du Cycle 1 (voir tableau 5). Chez les patients qui ne présentent pas de réaction liée à la perfusion de grade ≥ 3 au cours du Cycle 1, Gazyvaro peut être administré en perfusion de courte durée (environ 90 minutes) à partir du Cycle 2 (voir tableau 6).
Tableau 5 Lymphome folliculaire : Vitesse de perfusion standard et recommandations en cas de réaction liée à la perfusion lors de la perfusion précédente
Cycle | Jour du traitement | Vitesse de perfusion | |
Cycle 1 | J1 | Administrer à une vitesse de 50 mg/h. La vitesse de la perfusion pourra être augmentée par paliers de 50 mg/h toutes les 30 minutes, jusqu'à un maximum de 400 mg/h. | |
J8 | Sans réaction liée à la perfusion ou en cas de réaction liée à la perfusion de grade 1 lors de la perfusion précédente, lorsque la vitesse finale de la perfusion était ≥ 100 mg/h, les perfusions peuvent être débutées à une vitesse de 100 mg/h et augmentées par paliers de 100 mg/h toutes les 30 minutes jusqu'à un maximum de 400 mg/h. | ||
J15 | |||
Cycles 2 – 6 ou | J1 | ||
Entretien | Tous les 2 mois jusqu’à progression de la maladie ou pendant une durée maximale de 2 ans | ||
Tableau 6 Lymphome folliculaire : Vitesse de perfusion de courte durée et recommandations en cas de réaction liée à la perfusion lors de la perfusion précédente
Cycle | Jour du traitement | Vitesse de perfusion |
Cycles 2–6 ou 2–8 | J1 | Sans réaction liée à la perfusion de grade ≥ 3 lors du Cycle 1 : |
Entretien | |
Prise en charge des réactions liées à la perfusion (toutes indications)
La prise en charge des réactions liées à la perfusion peut nécessiter l'interruption temporaire, la réduction de la vitesse de perfusion ou l'arrêt du traitement par Gazyvaro, comme mentionné ci-dessous (voir également rubrique 4.4).
Grade 4 (menaçant le pronostic vital) : la perfusion doit être arrêtée et le traitement définitivement arrêté.
Grade 3 (sévère) : la perfusion doit être arrêtée temporairement et les symptômes traités. Après la résolution complète des symptômes, la perfusion peut être reprise à une vitesse réduite au moins de moitié par rapport à la vitesse initiale (vitesse au moment où la réaction liée à la perfusion s'est produite) et, si le patient ne présente plus aucun symptôme de réaction liée à la perfusion, l'augmentation de la vitesse de perfusion pourra être reprise selon les paliers et les intervalles appropriés pour la dose du traitement (voir les tableaux 4 à 6). Pour les patients atteints de LLC, recevant la dose de J1 (cycle 1) répartie sur deux jours, la vitesse de perfusion de J1 pourra être de nouveau augmentée à 25 mg/h après 1 heure, mais elle ne pourra pas être augmentée au-delà de 25 mg/h.
La perfusion doit être arrêtée et le traitement définitivement arrêté si le patient présente une seconde réaction liée à la perfusion de grade 3.
Grade 1-2 (légère à modérée) : la vitesse de perfusion doit être réduite et les symptômes traités. La perfusion peut être poursuivie dès la résolution complète des symptômes et, si le patient ne présente plus aucun symptôme de réaction liée à la perfusion, l'augmentation de la vitesse de perfusion pourra être reprise selon les paliers et les intervalles appropriés pour la dose du traitement (voir les tableaux 4 à 6). Pour les patients atteints de LLC recevant la dose de J1 (cycle 1) répartie sur deux jours, la vitesse de perfusion de J1 pourra être de nouveau augmentée à 25 mg/h après 1 heure, mais elle ne pourra pas être augmentée au-delà de 25 mg/h.
Prise en charge des réactions liées à la perfusion survenant au cours d'une perfusion de courte durée
Grade 4 (menace le pronostic vital) : la perfusion doit être arrêtée et le traitement définitivement arrêté
Grade 3 (sévère) : La perfusion doit être arrêtée temporairement et les symptômes traités. Après la résolution complète des symptômes, la perfusion peut être reprise à une vitesse réduite au moins de moitié par rapport à la vitesse initiale (vitesse au moment où la réaction liée à la perfusion s'est produite) et ne dépassant pas 400 mg/h.
Si le patient présente une seconde réaction liée à la perfusion de grade 3 après la reprise de la perfusion, la perfusion doit être arrêtée et le traitement doit être définitivement arrêté. Si le patient est capable de terminer la perfusion sans présenter d’autre réaction liée à la perfusion de grade 3, la perfusion suivante doit être administrée à une vitesse ne dépassant pas la vitesse standard.
Grade 1-2 (légère à modérée) : la vitesse de perfusion doit être réduite et les symptômes traités. La perfusion peut être poursuivie dès la résolution complète des symptômes et, si le patient ne présente plus aucun symptôme de réaction liée à la perfusion, l'augmentation de la vitesse de perfusion pourra être reprise selon les paliers et les intervalles appropriés pour la dose du traitement (voir les tableaux 5 et 6).
4.3 Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité d'emploi
Les effets indésirables issus des études cliniques ont été identifiés au cours du traitement d’induction, du traitement d’entretien et du suivi des patients atteints de lymphome non hodgkinien indolent (LNHi) dont le LF ; du traitement et du suivi des patients atteints de LLC dans les trois études cliniques pivots :
● BO21004/CLL11 (N = 781) : patients atteints de LLC non précédemment traités
● BO21223/GALLIUM (N = 1390) : patients atteints d’un LNHi non précédemment traités (86 % des patients avaient un LF)
● GAO4753g/GADOLIN (N = 409) : patients atteints de LNHi (81% des patients avaient un LF) en cas de non-réponse ou de progression, pendant ou dans les 6 mois suivant un traitement incluant du rituximab.
Ces études ont évalué Gazyvaro administré en association au chlorambucil pour la LLC et à la bendamustine, au CHOP ou au CVP, suivi de Gazyvaro en traitement d’entretien pour le LNHi. Les études BO21223/GALLIUM et GAO4753g/GADOLIN ont inclus des patients atteints d’un LNHi, notamment des patients atteints de LF. Par conséquent, afin de fournir des informations exhaustives sur la sécurité du médicament, l’analyse des effets indésirables présentée ci-après, a été réalisée sur la population totale de l’étude (c’est-à-dire LNHi).
Le tableau 7 résume tous les effets indésirables dont ceux des études pivots (BO21004/CLL11, BO21223/GALLIUM, GAO4753g/GADOLIN) survenus avec une incidence plus élevée (différence ≥ 2 %) versus le bras comparateur, dans au moins une étude pivot chez les :
● Patients atteints de LLC recevant Gazyvaro plus chlorambucil versus chlorambucil seul ou rituximab plus chlorambucil (étude BO21004/CLL11)
● Patients atteints d’un LNHi non précédemment traités recevant Gazyvaro plus chimiothérapie (bendamustine, CHOP, CVP), suivi de Gazyvaro en traitement d’entretien chez les patients répondeurs, versus rituximab plus chimiothérapie, suivi de rituximab en traitement d’entretien chez les patients répondeurs (étude BO21223/GALLIUM)
● Patients atteints d’un LNHi en cas de non-réponse ou de progression, pendant ou dans les 6 mois suivant un traitement incluant du rituximab recevant Gazyvaro plus bendamustine, suivi de Gazyvaro en traitement d’entretien chez certains patients versus bendamustine seule (étude GAO4753g/GADOLIN).
Les incidences présentées dans le tableau 7 (tout grade et grade 3 à 5) correspondent à l’incidence la plus élevée rapportée dans l’une des trois études pour cet effet indésirable.
Les fréquences sont définies de la façon suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et de fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Pour chaque groupe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
Tableau résumé des effets indésirables
Tableau 7 Résumé des effets indésirables rapportés chez les patients# recevant Gazyvaro + chimiothérapie*
Système classe-organe | Tout grade | Grade 3 à 5† | ||||
Infections et infestations | ||||||
Très fréquent | Infection des voies respiratoires supérieures, sinusite§, infection des voies urinaires, pneumonie§, zona§, rhinopharyngite |
| ||||
Fréquent | Herpès buccal, rhinite, pharyngite, infection pulmonaire, grippe | Infection des voies urinaires, pneumonie, infection pulmonaire, infection des voies respiratoires supérieures, sinusite, zona | ||||
Peu fréquent | Réactivation d’hépatite B | Rhinopharyngite, rhinite, grippe, herpès buccal | ||||
Tumeurs bénignes, malignes et non précisées (dont kystes et polypes) | ||||||
Fréquent | Carcinome épidermoïde cutané, carcinome basocellulaire | Carcinome épidermoïde cutané, carcinome basocellulaire | ||||
Affections hématologiques et du système lymphatique | ||||||
Très fréquent | Neutropénie§, thrombopénie, anémie, leucopénie | Neutropénie, thrombopénie | ||||
Fréquent | Neutropénie fébrile | Anémie, leucopénie, neutropénie fébrile | ||||
Peu fréquent | Coagulation intravasculaire disséminée## |
| ||||
Troubles du métabolisme et de la nutrition | ||||||
Fréquent | Syndrome de lyse tumorale, hyperuricémie, hypokaliémie | Syndrome de lyse tumorale, hypokaliémie | ||||
Peu fréquent |
| Hyperuricémie | ||||
Affections psychiatriques | ||||||
Très fréquent | Insomnie |
| ||||
Fréquent | Dépression, anxiété |
| ||||
Peu fréquent |
| Insomnie, dépression, anxiété | ||||
Affections du système nerveux | ||||||
Très fréquent | Céphalées |
| ||||
Peu fréquent |
| Céphalées | ||||
Indéterminée | Leucoencéphalopathie multifocale progressive |
| ||||
Affections cardiaques | ||||||
Fréquent | Fibrillation auriculaire | Fibrillation auriculaire | ||||
Affections vasculaires | ||||||
Fréquent | Hypertension | Hypertension | ||||
Affections respiratoires, thoraciques et médiastinales | ||||||
Très fréquent | Toux§ |
| ||||
Fréquent | Congestion nasale, rhinorrhée, douleur oropharyngée |
| ||||
Peu fréquent |
| Toux, douleur oropharyngée | ||||
Affections gastro-intestinales | ||||||
Très fréquent | Diarrhée, constipation§ |
| ||||
Fréquent | Dyspepsie, hémorroïdes, perforation gastro-intestinale | Diarrhée | ||||
Peu fréquent |
| Constipation, hémorroïdes | ||||
Affections de la peau et du tissu sous-cutané | ||||||
Très fréquent | Alopécie, prurit |
| ||||
Fréquent | Eczéma |
| ||||
Peu fréquent |
| Prurit | ||||
Affections musculosquelettiques et du tissu conjonctif | ||||||
Très fréquent | Arthralgie§, douleurs dorsales, douleurs dans les extrémités |
| ||||
Fréquent | Douleurs thoraciques musculo-squelettiques, douleurs osseuses | Douleurs dans les extrémités | ||||
Peu fréquent |
| Arthralgie, douleurs dorsales, douleurs thoraciques musculo-squelettiques, douleurs osseuses | ||||
Affections du rein et des voies urinaires | ||||||
Fréquent | Dysurie, incontinence urinaire |
| ||||
Peu fréquent |
| Dysurie, incontinence urinaire | ||||
Troubles généraux et anomalies au site d'administration | ||||||
Très fréquent | Fièvre, asthénie, fatigue |
| ||||
Fréquent | Douleurs thoraciques | Fièvre, asthénie, fatigue | ||||
Peu fréquent |
| Douleurs thoraciques | ||||
Affections du système immunitaire | ||||||
Rare | Syndrome de relargage des cytokines** |
| ||||
Investigations | ||||||
Fréquent | Diminution du nombre de globules blancs, diminution du nombre de polynucléaires neutrophiles, prise de poids | Diminution du nombre de globules blancs, diminution du nombre de polynucléaires neutrophiles | ||||
Peu fréquent | Hypogammaglobulinémie |
| ||||
Lésions, intoxications et complications d’interventions | ||||||
Très fréquent | Réactions liées à la perfusion | Réactions liées à la perfusion | ||||
# Seule la fréquence la plus élevée observée dans les études est rapportée (sur la base des études BO21004 / patients atteints de LLC non précédemment traités, BO21223 / patients atteints de LNHi avancé non précédemment traités et GAO4753g / patients atteints de LNHi réfractaires au rituximab)
## Une coagulation intravasculaire disséminée (CIVD), incluant des cas fatals, a été rapportée dans des études cliniques et dans le cadre de la surveillance post-commercialisation chez des patients recevant Gazyvaro (voir rubrique 4.4)
† Aucun effet indésirable de grade 5 n'a été observé avec une différence ≥ 2 % entre les bras de traitement
* Chimiothérapie : chlorambucil dans la LLC ; bendamustine, CHOP, CVP dans le LNHi, incluant le LF
§ observé également au cours du traitement d’entretien avec une incidence plus élevée d’au moins 2 % dans le bras Gazyvaro (BO21223)
** Sur la base de l’exposition dans les essais cliniques dans le LF et la LLC
Le profil d’effets indésirables chez les patients atteints de LF a été cohérent avec celui de la population générale atteinte de LNHi dans les deux études.
Description de certains effets indésirables
Les incidences présentées dans les sections suivantes, lorsqu’elles concernent le LNHi, correspondent à l’incidence de cet effet indésirable la plus élevée rapportée dans l’une ou l’autre des études pivots (BO21223/GALLIUM, GAO4753g/GADOLIN).
L’étude MO40597 a été conçue pour caractériser le profil de sécurité d’emploi des perfusions de courte durée (environ 90 minutes), à partir du Cycle 2, chez les patients atteints de LF non précédemment traité (voir rubrique 5.1 Propriétés pharmacodynamiques).
Réactions liées à la perfusion
Les symptômes les plus fréquemment rapportés (≥ 5 %) associés aux réactions liées à la perfusion ont été les suivants : nausées, vomissements, diarrhée, céphalées, étourdissements, fatigue, frissons, fièvre, hypotension, bouffées vasomotrices, hypertension, tachycardie, dyspnée, et gêne thoracique. Des symptômes respiratoires tels que bronchospasme, irritation du larynx et de la gorge, sifflement respiratoire, œdème laryngé et des symptômes cardiaques tels que fibrillation auriculaire, ont également été rapportés (voir rubrique 4.4).
Leucémie lymphoïde chronique
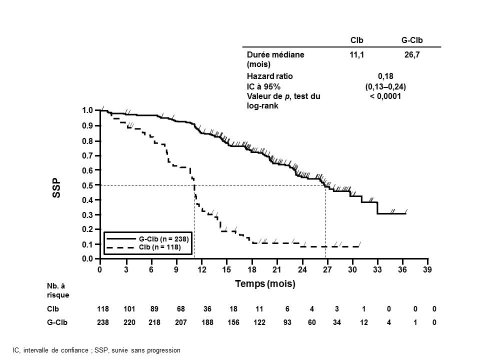
L’incidence des réactions liées à la perfusion était plus élevée dans le groupe Gazyvaro plus chlorambucil par rapport à celle observée dans le groupe rituximab plus chlorambucil. L'incidence des réactions liées à la perfusion a été de 66 % lors de la perfusion des 1 000 premiers mg de Gazyvaro (20 % des patients ont présenté une réaction liée à la perfusion de grade 3 à 4). Dans l'ensemble, 7 % des patients ont présenté une réaction liée à la perfusion conduisant à l'arrêt de Gazyvaro. L'incidence des réactions liées à la perfusion lors des perfusions ultérieures a été de 3 % lors de la deuxième dose de 1 000 mg et de 1 % par la suite. Aucune réaction liée à la perfusion de grade 3 à 5 n'a été rapportée après la perfusion des 1 000 premiers mg du cycle 1.
Chez les patients ayant bénéficié des mesures recommandées pour la prévention des réactions liées à la perfusion décrites à la rubrique 4.2, une diminution de l'incidence des réactions liées à la perfusion tous grades confondus a été observée. Les taux de réactions liées à la perfusion de grade 3 à 4 (survenant chez un nombre relativement faible de patients) ont été similaires avant et après la mise en œuvre des mesures de minimisation du risque.
Lymphome non hodgkinien indolent incluant le lymphome folliculaire
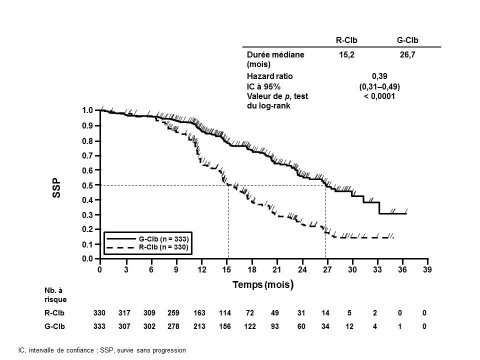
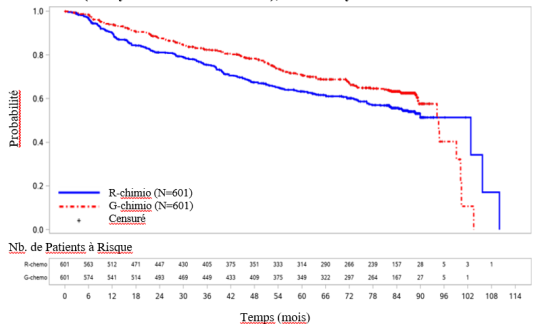
Des réactions liées à la perfusion de grade 3 à 4 sont survenues chez 12 % des patients. Au cours du cycle 1, l’incidence globale des réactions liées à la perfusion a été plus élevée chez les patients recevant Gazyvaro plus chimiothérapie par rapport aux patients du bras comparateur. Chez les patients recevant Gazyvaro plus chimiothérapie, l’incidence des réactions liées à la perfusion a été la plus élevée à J1 et elle a diminué progressivement lors des perfusions suivantes. Cette tendance à la baisse s’est poursuivie pendant le traitement d’entretien par Gazyvaro seul. Au-delà du cycle 1, l’incidence des réactions liées à la perfusion lors des perfusions suivantes a été comparable entre les deux bras. Dans l’ensemble, 4 % des patients ont présenté une réaction liée à la perfusion entraînant l’arrêt de Gazyvaro.
Perfusions de courte durée chez les patients atteints de lymphome folliculaire
Dans l'étude MO40597 évaluant la sécurité d’emploi des perfusions de courte durée, une plus grande proportion de patients a présenté des réactions liées à la perfusion de tout grade au cycle 2 par rapport à la proportion de patients ayant présenté des réactions liées à la perfusion après la perfusion à une vitesse standard au cycle 2 dans l'étude BO21223 (10/99 [10,1 %] contre 23/529 [4,3 %] respectivement ; réactions liées à la perfusion attribuées par l'investigateur à tout composant du traitement de l'étude). Aucun patient n'a présenté de réactions liées à la perfusion de grade 3 après la perfusion de courte durée au cycle 2 dans l'étude MO40597 ; 3/529 (0,6 %) ont présenté des réactions liées à la perfusion de grade 3 au cycle 2 dans l'étude BO21223. Les symptômes et les signes des réactions liées à la perfusion étaient similaires dans les deux études.
Les réactions liées à la perfusion observées dans l'étude MO40597/GAZELLE sont résumées dans le tableau 8.
Tableau 8 Etude MO40597/GAZELLE Perfusion de courte durée: Réactions liées à la perfusiona par Cycle (population évaluable pour la sécurité d’emploi)
Grade CTCAE | C1 Total | C1b par jour | C2C | C3 | C4 | C5 | C6 | C7 | Sur l’ensemble des cycles d’induction | ||||||||||
Jour 1 | Jour 2d | Jour 8 | Jour 15 | ||||||||||||||||
Tous Grades | 65/113 (57,5%) | 57/113 (50,4%) | 4/51 (7,8%) | 6/112 (5,4%) | 5/111 (4,5%) | 13/110 (11,8%) | 9/108 (8,3%) | 7/108 (6,5%) | 6/107 (5,6%) | 5/105 (4,8%) | 2/55 (3,6%) | 71/113 | |||||||
Grade 3 | 6/113 (5,3%) | 5/113 (4,4%) | 1/51 (2,0%) | 0 | 0 | 0 | 0 | 0 | 1/107 (0,9%) | 0 | 0 | 7/113 | |||||||
Ccycle; CTCAE = Common Terminology Criteria for Adverse Events;
a Réaction liée à la perfusion définie comme tout événement survenu pendant ou dans les 24 heures suivant la fin de la perfusion du traitement de l'étude et jugé par l'investigateur comme étant lié à l'un des composants du traitement.
b Le C1 comprenait trois perfusions à la vitesse de perfusion standard, administrées à intervalles hebdomadaires.
c Les patients ont reçu une perfusion de courte durée à partir du C2. Le dénominateur à C2 et aux cycles suivants représente le nombre de patients ayant reçu une perfusion de courte durée à ce cycle.
d Patients traités par bendamustine au jour 2 du Cycle 1.
Neutropénie et infections
Leucémie lymphoïde chronique
L'incidence des neutropénies a été plus élevée dans le groupe Gazyvaro plus chlorambucil (41 %) par rapport au groupe rituximab plus chlorambucil, la neutropénie se résolvant spontanément ou avec l'utilisation de facteurs de croissance granulocytaire. L'incidence des infections a été de 38 % dans le groupe Gazyvaro plus chlorambucil et de 37 % dans le groupe rituximab plus chlorambucil (des événements de grade 3 à 5 étant rapportés chez respectivement 12 % et 14 % des patients et des événements fatals chez < 1 % des patients dans les deux groupes de traitement). Des cas de neutropénie prolongée (2 % dans le groupe Gazyvaro plus chlorambucil et 4 % dans le groupe rituximab plus chlorambucil) et de neutropénie tardive (16 % dans le groupe Gazyvaro plus chlorambucil et 12 % dans le groupe rituximab plus chlorambucil) ont également été rapportés (voir rubrique 4.4).
Lymphome non hodgkinien indolent incluant le lymphome folliculaire
Dans le bras Gazyvaro plus chimiothérapie, l'incidence des neutropénies de grade 1 à 4 (50%) a été plus élevée par rapport au bras comparateur, avec un risque accru au cours de la période d’induction. L’incidence de neutropénie prolongée et de neutropénie tardive a été respectivement de 3 % et 8 %. L'incidence des infections a été de 81% dans le bras Gazyvaro plus chimiothérapie (des événements de grade 3 à 5 étant rapportés chez 22% des patients et des événements fatals étant rapportés chez 3 % des patients).
Les patients ayant reçu une prophylaxie par G-CSF ont présenté un taux plus faible d’infections de grade 3 à 5 (voir rubrique 4.4).
Perfusions de courte durée chez les patients atteints de lymphome folliculaire
Dans l'étude MO40597, évaluant la sécurité d’emploi de la perfusion de courte durée, la neutropénie a été signalée comme un événement indésirable survenu chez une proportion plus élevée de patients par rapport à l'étude BO21223 dans laquelle les patients ont reçu une perfusion de durée standard 69/113 [61,1%] contre 247/595 [41,5%], respectivement, tout au long de l'induction). La médiane et l'intervalle des valeurs de la numération des neutrophiles étaient similaires dans les deux études à chaque étape clé. Une neutropénie fébrile a été rapportée chez une proportion similaire de patients dans les études MO40597 et BO21223 (6/113 [5,3%] contre 31/595 [5,2%], respectivement). Les infections ont été rapportées moins fréquemment dans l’étude MO40597 que dans l’étude BO21223 (45/113 [39,8%] contre 284/595 [47,7%], respectivement).
Thrombopénie et événements hémorragiques
Leucémie lymphoïde chronique
L'incidence des thrombopénies a été plus élevée dans le groupe Gazyvaro plus chlorambucil que dans le groupe rituximab plus chlorambucil (16% versus 7%), notamment au cours du premier cycle. Quatre pour cent des patients traités par Gazyvaro plus chlorambucil ont présenté une thrombopénie aiguë (survenant au cours des 24 heures suivant la perfusion de Gazyvaro) (voir rubrique 4.4). L'incidence globale des événements hémorragiques a été similaire dans le groupe traité par Gazyvaro et dans le groupe traité par le rituximab. Les nombres d'événements hémorragiques fatals ont été équilibrés entre les groupes de traitement ; en revanche, tous les événements chez les patients traités par Gazyvaro ont été rapportés au cours du cycle 1. Aucun événement de thrombopénie de grade 5 n’a été rapporté. Il n'a pas été établi de relation claire entre la thrombopénie et les événements hémorragiques.
Lymphome non hodgkinien indolent incluant le lymphome folliculaire
L'incidence des thrombopénies a été de 15 %. Les thrombopénies ont été plus fréquentes au cours du cycle 1 dans le bras Gazyvaro plus chimiothérapie. Les thrombopénies survenant pendant ou au cours des 24 heures suivant la fin de la perfusion (thrombopénies aiguës) ont été plus fréquentes chez les patients du bras Gazyvaro plus chimiothérapie que dans le bras comparateur. L'incidence des événements hémorragiques a été similaire dans tous les bras de traitement. Des événements hémorragiques et des événements hémorragiques de grade 3 à 5 sont survenus chez respectivement 12 % et 4 % des patients. Des événements hémorragiques fatals se sont produits chez moins de 1 % des patients ; aucun n’est survenu au cours du cycle 1.
Perfusions de courte durée chez les patients atteints de lymphome folliculaire
Dans l'étude MO40597, évaluant la sécurité d’emploi des perfusions de courte durée, la thrombocytopénie a été signalée comme un événement indésirable dans une proportion plus élevée de patients par rapport à l'étude BO21223 dans laquelle les patients ont reçu une perfusion de durée standard (21/113 [28,6%] contre 63/595 [10,6%], respectivement, tout au long de l'induction). La médiane et l'intervalle des valeurs de la numération plaquettaire étaient similaires dans les deux études à chaque étape clé. Aucun événement de thrombocytopénie rapporté dans l’étude MO40597 n'a été associé à des saignements.
Populations particulières
Patients âgés
Leucémie lymphoïde chronique
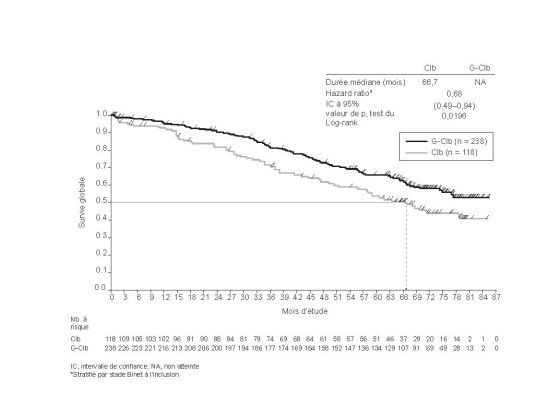
Dans l'étude pivot BO21004/CLL11, 46 % (156 sur 336) des patients atteints de LLC traités par Gazyvaro plus chlorambucil étaient âgés de 75 ans ou plus (l'âge médian était de 74 ans). Ces patients ont présenté plus d'événements indésirables graves et d'événements indésirables d’issue fatale que les patients âgés < 75 ans.
Lymphome non hodgkinien indolent incluant le lymphome folliculaire
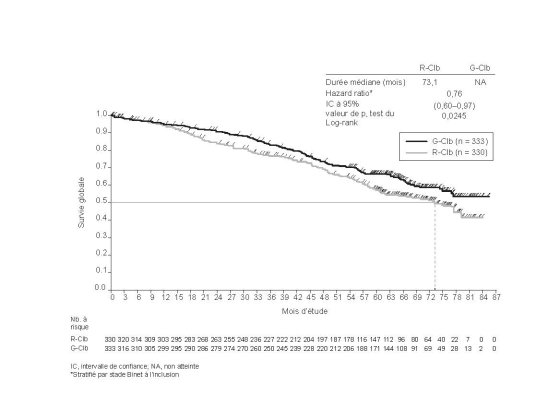
Dans les études pivots (BO21223/GALLIUM, GAO4753g/GADOLIN) dans le LNHi, les patients âgés de 65 ans ou plus ont présenté plus d’événements indésirables graves et d’événements indésirables entraînant l’arrêt du traitement ou le décès que les patients de moins de 65 ans.
Insuffisance rénale
Leucémie lymphoïde chronique
Dans l'étude pivot BO21004/CLL11, 27 % (90 sur 336) des patients traités par Gazyvaro plus chlorambucil présentaient une insuffisance rénale modérée (ClCr < 50 mL/min). Ces patients ont présenté plus d'événements indésirables graves et d'événements indésirables d’issue fatale que les patients avec une ClCr ≥ 50 mL/min (voir rubriques 4.2, 4.4 et 5.2). Les patients avec une ClCr < 30 mL/min ont été exclus de l’étude (voir rubrique 5.1).
Lymphome non hodgkinien indolent incluant le lymphome folliculaire
Dans les études pivots (BO21223/GALLIUM, GAO4753g/GADOLIN) dans le LNHi, respectivement 5 % (35 sur 698) et 7 % (14 sur 204) de patients traités par Gazyvaro présentaient une insuffisance rénale modérée (ClCr < 50 mL/min). Ces patients ont présenté plus d'événements indésirables graves, d'événements indésirables de grade 3 à 5 et d’événements indésirables entraînant l’arrêt du traitement (uniquement les patients de l’étude BO21223) que les patients avec une ClCr ≥ 50 mL/min (voir rubriques 4.2 et 5.2). Les patients avec une ClCr < 40 mL/min ont été exclus des études (voir rubrique 5.1).
Informations de sécurité supplémentaires issues des études cliniques
Aggravation de pathologies cardiaques préexistantes
Des cas d’arythmie (telles que fibrillation auriculaire et tachyarythmie), un angor, un syndrome coronarien aigu, un infarctus du myocarde et une insuffisance cardiaque ont été observés sous traitement par Gazyvaro (voir rubrique 4.4). Ces événements peuvent se produire dans le contexte d'une réaction liée à la perfusion et peuvent être fatals.
Anomalies biologiques
Une élévation transitoire des enzymes hépatiques (aspartate aminotransférase [ASAT], alanine aminotransférase [ALAT], phosphatases alcalines) a été observée peu de temps après la première perfusion de Gazyvaro.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir ci-dessous).
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/14/937/001
10. DATE DE MISE À JOUR DU TEXTE
5 juin 2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l'Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3167483 | GAZYVARO 1000 MG SOL PR PERF 1 FL 1000MG/40ML | L01FA03 | - | € 2939,27 | Oui | - | - |