RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Perjeta 420 mg solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon de solution à diluer de 14 mL contient 420 mg de pertuzumab, à une concentration de
30 mg/mL. Après dilution, un mL de solution contient environ 3,02 mg de pertuzumab pour la dose initiale et environ 1,59 mg de pertuzumab pour la dose d’entretien (voir rubrique 6.6).
Le pertuzumab est un anticorps monoclonal humanisé de classe IgG1 produit par une culture de cellules de mammifère (ovaire de hamster chinois), par la technique de l’ADN recombinant.
Excipient à effet notoire :
Chaque flacon de 14 mL contient 2,8 mg de polysorbate 20.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion.
Liquide incolore à jaune pâle, limpide à légèrement opalescent.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Cancer du sein précoce
Perjeta est indiqué en association au trastuzumab et à une chimiothérapie, dans :
le traitement néoadjuvant de patients adultes atteints d'un cancer du sein HER2 positif localement avancé, inflammatoire ou à un stade précoce avec un risque élevé de récidive (voir rubrique 5.1)
le traitement adjuvant de patients adultes atteints d'un cancer du sein précoce HER2 positif avec un risque élevé de récidive (voir rubrique 5.1).
Cancer du sein métastatique
Perjeta est indiqué en association au trastuzumab et au docétaxel, dans le traitement de patients adultes atteints d’un cancer du sein métastatique ou localement récidivant non résécable HER2 positif, n’ayant pas reçu au préalable de traitement anti-HER2 ou de chimiothérapie pour leur maladie métastatique.
4.2 Posologie et mode d’administration
Le traitement par Perjeta doit être uniquement initié sous la surveillance d’un médecin expérimenté dans l'administration d’agents anticancéreux. Perjeta doit être administré par un professionnel de santé prêt à prendre en charge des réactions anaphylactiques et dans un environnement où un équipement complet de réanimation est immédiatement disponible.
Posologie
Les patients traités avec Perjeta doivent présenter un statut tumoral HER2 positif, défini par un score
3+ par immunohistochimie (IHC) et/ou un ratio ≥ 2,0 par hybridation in situ (HIS), déterminé par une
méthode validée.
Afin d’assurer des résultats précis et reproductibles, le test HER2 doit être réalisé dans un laboratoire
spécialisé, qui peut garantir la validation des méthodes de test. Pour des instructions complètes sur la
réalisation du test et son interprétation, se référer aux notices d’information des méthodes
de test HER2 validées.
La dose de charge initiale recommandée du pertuzumab est de 840 mg administrée en perfusion intraveineuse de 60 minutes, suivie toutes les trois semaines d’une dose d’entretien de 420 mg administrée sur une période de 30 à 60 minutes. Une période d’observation de 30 - 60 minutes est recommandée après la fin de chaque perfusion. Les perfusions suivantes de trastuzumab ou d’une chimiothérapie ne peuvent être réalisées qu’après la fin de la période d’observation (voir rubrique 4.4).
Perjeta et le trastuzumab doivent être administrés de façon séquentielle et ne doivent pas être mélangés dans la même poche pour perfusion. Perjeta et le trastuzumab peuvent être administrés dans n’importe quel ordre. Lorsque le trastuzumab est administré en association à Perjeta, la recommandation est de suivre un schéma posologique toutes les trois semaines pour le trastuzumab administré :
soit en perfusion intraveineuse avec une dose de charge initiale de trastuzumab de 8 mg/kg de poids corporel, suivie toutes les trois semaines d’une dose d’entretien de 6 mg/kg de poids corporel
ou
en injection sous-cutanée à dose fixe (600 mg) de trastuzumab toutes les trois semaines, quel que soit le poids corporel du patient.
Chez les patients recevant un taxane, Perjeta et le trastuzumab doivent être administrés avant le taxane.
Lorsqu’il est administré en association à Perjeta, le docétaxel peut être initié à la dose de 75 mg/m2 et cette dose peut être augmentée à 100 mg/m2, selon le schéma thérapeutique choisi et la tolérance de la dose initiale. Sinon, le docétaxel peut être administré à la dose de 100 mg/m2 toutes les 3 semaines depuis l’initiation, selon le schéma thérapeutique choisi. Si un traitement à base de carboplatine est utilisé, la dose recommandée du docétaxel est de 75 mg/m2 tout au long du traitement (pas d’augmentation de la dose). Lorsqu’il est administré en association à Perjeta en situation adjuvante, la dose recommandée du paclitaxel est de 80 mg/m2 une fois par semaine pendant 12 cycles hebdomadaires.
Chez les patients recevant un traitement à base d’anthracycline, Perjeta et le trastuzumab doivent être administrés après l’administration de la totalité du traitement à base d’anthracycline (voir rubrique 4.4).
Cancer du sein métastatique
Perjeta doit être administré en association au trastuzumab et au docétaxel. Le traitement par Perjeta et le trastuzumab peut être poursuivi jusqu’à progression de la maladie ou survenue d’une toxicité inacceptable, même en cas d’arrêt du traitement par le docétaxel.
Cancer du sein précoce
En situation néoadjuvante, Perjeta doit être administré pendant 3 à 6 cycles, en association au trastuzumab et à une chimiothérapie, dans le cadre d’un traitement complet d’un cancer du sein précoce (voir rubrique 5.1).
En situation adjuvante, Perjeta doit être administré en association au trastuzumab pendant une période totale d’un an (jusqu’à 18 cycles ou jusqu’à rechute de la maladie ou survenue d’une toxicité inacceptable, en fonction de l’évènement se produisant en premier) dans le cadre d’un traitement complet d’un cancer du sein précoce et quel que soit le moment de la chirurgie. Le traitement doit inclure une chimiothérapie standard à base d’un taxane et/ou d’anthracycline. L’administration de Perjeta et du trastuzumab doit débuter au Jour 1 du premier cycle de traitement à base de taxane et elle doit être poursuivie même en cas d’arrêt de la chimiothérapie.
Oubli ou retard de dose
Pour les recommandations en cas d’oubli ou retard de dose, veuillez vous référer au tableau 1
ci-dessous.
Tableau 1 Recommandations en cas d’oubli ou retard de dose
Délai entre deux perfusions consécutives | Perjeta | trastuzumab | |
IV | SC | ||
< 6 semaines | La dose de 420 mg de pertuzumab doit être administrée dès que possible. Ne pas attendre jusqu’à la prochaine dose planifiée. Par la suite, revenir au calendrier d’administration initial. | La dose de 6 mg/kg de trastuzumab IV doit être administrée dès que possible. Ne pas attendre jusqu’à la prochaine dose planifiée. Par la suite, revenir au calendrier d’administration initial. | La dose fixe de |
≥ 6 semaines | La dose de charge de | La dose de charge de 8 mg/kg de trastuzumab IV doit être à nouveau administrée en perfusion intraveineuse de 90 minutes, suivie par la suite d’une dose d’entretien de 6 mg/kg IV administrée toutes les trois semaines. | |
Modification de dose
Des diminutions de dose ne sont pas recommandées pour Perjeta ou le trastuzumab. Pour obtenir des informations supplémentaires sur le trastuzumab, veuillez vous référer au Résumé des Caractéristiques du Produit (RCP).
Les patients peuvent poursuivre le traitement au cours des périodes de myélosuppression réversible induite par la chimiothérapie. Cependant, ils doivent être étroitement surveillés durant ces périodes pour identifier des complications de neutropénie. Pour les modifications de dose du docétaxel et des autres chimiothérapies, se référer au RCP correspondant.
Si le traitement avec le trastuzumab est arrêté, le traitement avec Perjeta doit être interrompu.
Dysfonction ventriculaire gauche
L’administration de Perjeta et du trastuzumab doit être suspendue pendant au moins 3 semaines en cas de survenue de signes cliniques et de symptômes suggérant une insuffisance cardiaque congestive. Le traitement par Perjeta doit être interrompu si une insuffisance cardiaque symptomatique est confirmée (voir rubrique 4.4 pour des informations supplémentaires).
Patients atteints d’un cancer du sein métastatique
Avant l’administration du traitement, les patients doivent présenter une fraction d’éjection ventriculaire gauche (FEVG) ≥ 50 %. L’administration de Perjeta et du trastuzumab doit être suspendue pendant au moins 3 semaines en cas :
de diminution de la FEVG à une valeur inférieure à 40 %.
de FEVG de 40 % - 45 % associée à une diminution ≥ 10 % des points par rapport aux valeurs initiales.
Perjeta et le trastuzumab peuvent être réintroduits si la FEVG s’est améliorée, atteignant une valeur
45 % ou de 40 % - 45 % associée à une différence 10 % des points par rapport aux valeurs initiales.
Patients atteints d’un cancer du sein précoce
Avant l’administration du traitement, les patients doivent présenter une FEVG ≥ 55 % (≥ 50 % après l’administration de la chimiothérapie à base d’anthracycline, le cas échéant). L’administration de Perjeta et du trastuzumab doit être suspendue pendant au moins 3 semaines en cas :
• de diminution de la FEVG à une valeur inférieure à 50 % associée à une diminution ≥ 10 % des points par rapport aux valeurs initiales.
Perjeta et le trastuzumab peuvent être réintroduits si la FEVG s’est améliorée, atteignant une valeur
≥ 50 % ou une différence 10 % des points par rapport aux valeurs initiales.
Patients âgés
Aucune différence globale en terme d’efficacité de Perjeta n’a été observée chez les patients âgés de 65 ans et plus et ceux âgés de moins de 65 ans. Aucune adaptation de posologie n’est requise chez les patients âgés de 65 ans et plus. Des données limitées sont disponibles chez les patients âgés de plus de 75 ans. Veuillez vous référer à la rubrique 4.8 pour l’évaluation de la sécurité de Perjeta chez les patients âgés.
Insuffisance rénale
Aucune adaptation de posologie du pertuzumab n’est requise chez les patients présentant une insuffisance rénale légère ou modérée. Aucune recommandation de dose ne peut être faite chez les patients présentant une insuffisance rénale sévère, les données pharmacocinétiques disponibles étant limitées (voir rubrique 5.2).
Insuffisance hépatique
La sécurité et l’efficacité de Perjeta n’ont pas été étudiées chez les patients avec une insuffisance hépatique. Aucune recommandation spécifique de dose ne peut être faite.
Population pédiatrique
La sécurité et l’efficacité de Perjeta chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Il n’existe pas d’utilisation justifiée de Perjeta dans la population pédiatrique dans l’indication de cancer du sein.
Mode d’administration
Perjeta est administré en perfusion intraveineuse. Il ne doit pas être administré en injection rapide ou bolus intraveineux. Pour les instructions concernant la dilution de Perjeta avant administration, voir les rubriques 6.2 et 6.6.
Pour la dose initiale, la durée de perfusion recommandée est de 60 minutes. Si la première perfusion est bien tolérée, les perfusions suivantes peuvent être administrées sur une période de 30 minutes à
60 minutes (voir rubrique 4.4).
Réactions à la perfusion
La vitesse de perfusion doit être ralentie ou l’administration doit être interrompue si le patient développe une réaction à la perfusion (voir rubrique 4.8). La perfusion peut être reprise après disparition des symptômes. Un traitement comprenant de l’oxygène, des bêta-agonistes, des antihistaminiques, des solutés par voie I.V. directe et des antipyrétiques peut également contribuer à soulager les symptômes.
Réactions d’hypersensibilité/anaphylactiques
La perfusion doit être immédiatement et définitivement interrompue si le patient présente une réaction de grade 4 selon la classification NCI-CTCAE (réaction anaphylactique), un bronchospasme ou un syndrome de détresse respiratoire aiguë (voir rubrique 4.4).
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
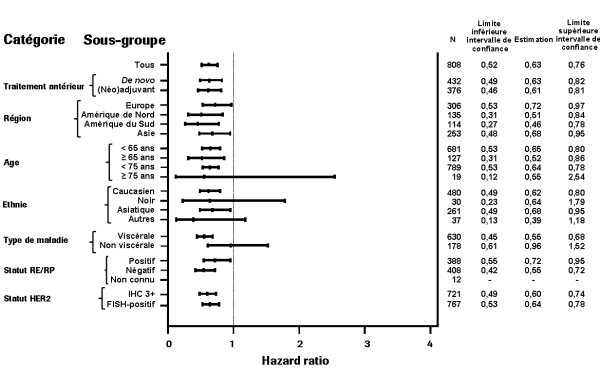
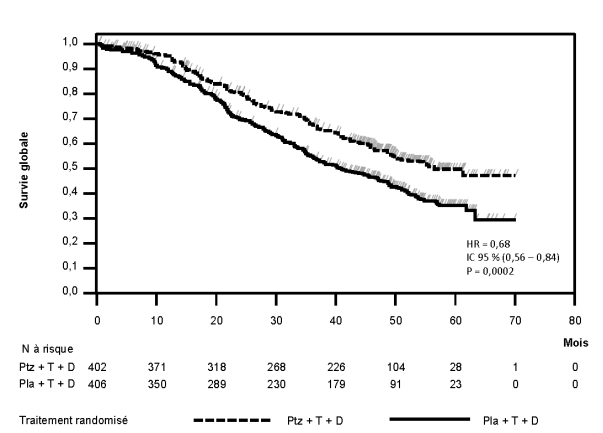
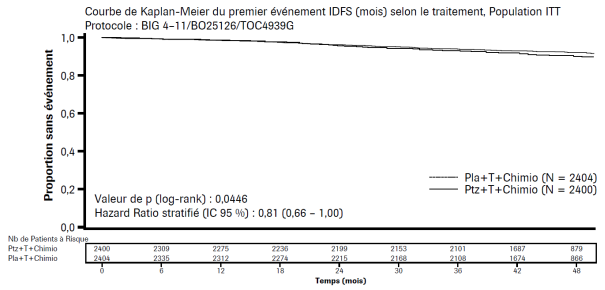
La sécurité de Perjeta a été évaluée chez plus de 6 000 patients dans des études cliniques de phase I, de phase II et de phase III chez des patients présentant diverses tumeurs malignes et traités en majorité avec Perjeta en association à d’autres agents antinéoplasiques. Ces études cliniques comprenaient les études pivotales CLEOPATRA (n = 808), NEOSPHERE (n = 417), TRYPHAENA (n = 225) et APHINITY (n = 4 804) [regroupées dans le tableau 2]. La sécurité de Perjeta était généralement cohérente entre les différentes études, bien que l'incidence et les effets indésirables les plus fréquents aient varié selon que l'administration de Perjeta soit en monothérapie ou en association à d'autres agents antinéoplasiques.
Tableau des effets indésirables
Sont présentés dans le tableau 2 les effets indésirables rapportés dans les groupes traités par Perjeta lors des études cliniques pivotales suivantes :
CLEOPATRA, au cours de laquelle Perjeta a été administré en association au docétaxel et au trastuzumab à des patients atteints d’un cancer du sein métastatique (n = 453)
NEOSPHERE (n = 309) et TRYPHAENA (n = 218), au cours desquelles Perjeta a été administré en traitement néoadjuvant en association au trastuzumab et à une chimiothérapie à des patients atteints d'un cancer du sein localement avancé, inflammatoire ou précoce
APHINITY, au cours de laquelle Perjeta a été administré en traitement adjuvant en association au trastuzumab et à une chimiothérapie à base de taxane, avec ou sans anthracycline, à des patients atteints d’un cancer du sein précoce (n = 2 364)
Les effets indésirables rapportés depuis la commercialisation sont également incluses dans le tableau 2. Perjeta ayant été utilisé avec le trastuzumab et une chimiothérapie dans ces études cliniques, il est difficile d’évaluer avec certitude le lien de causalité entre un événement indésirable et un médicament particulier.
Les effets indésirables sont listés ci-dessous selon la classification MedDRA des classes de systèmes d’organes (SOC) et les catégories de fréquence :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100, <1/10)
Peu fréquent (≥ 1/1 000, <1/100)
Rare (≥ 1/10 000, <1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Au sein de chaque groupe de fréquence et de classe de systèmes d’organes (SOC), les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Les effets indésirables les plus fréquents (≥ 30 %) issus de ces données poolées étaient une diarrhée, une alopécie, des nausées, une fatigue, une neutropénie et des vomissements. Les effets indésirables de grade 3 - 4 selon la classification NCI-CTCAE les plus fréquents (≥ 10 %) étaient une neutropénie et une neutropénie fébrile.
Tableau 2 Résumé des effets indésirables rapportés chez les patients traités avec Perjeta dans les essais cliniques^ et depuis la commercialisation†
Classe de systèmes d’organes | Très fréquent | Fréquent | Peu fréquent | Rare |
Infections et infestations | Rhinopharyngite | Paronychie |
|
|
Affections hématologiques et du système lymphatique | Neutropénie fébrile* |
|
|
|
Affections du système immunitaire | Réaction à la perfusion °°,* | Hypersensibilité°,* Hypersensibilité médicamenteuse°,* | Réaction anaphylactique°,* | Syndrome de relargage des cytokines°° |
Troubles du métabolisme et de la nutrition | Diminution de l’appétit |
|
| Syndrome de lyse tumorale† |
Affections psychiatriques | Insomnie |
|
|
|
Affections du système nerveux | Neuropathie périphérique |
|
|
|
Affections oculaires | Augmentation de la sécrétion lacrymale |
|
|
|
Affections cardiaques |
| Dysfonction ventriculaire gauche** | Insuffisance cardiaque congestive** |
|
Troubles vasculaires | Bouffées de chaleur |
|
|
|
Affections respiratoires, thoraciques et médiastinales | Toux | | Pneumopathie interstitielle |
|
Affections gastro-intestinales | Diarrhée |
|
|
|
Affections de la peau et du tissu sous-cutané | Alopécie |
|
|
|
Affections musculo-squelettiques et systémiques | Myalgie |
|
|
|
Troubles généraux et anomalies au site d'administration | Inflammation des muqueuses | Frissons |
|
|
^ Le tableau 2 montre les données poolées issues de la période totale de traitement dans l’étude clinique CLEOPATRA (date de clôture du recueil des données le 11 Février 2014 ; le nombre médian de cycles de Perjeta était de 24), de la période de traitement néoadjuvant dans l’étude clinique NEOSPHERE (le nombre médian de cycles de Perjeta était de 4 pour tous les bras de traitement) et dans l’étude clinique TRYPHAENA (le nombre médian de cycles de Perjeta était de 3 – 6 pour tous les bras de traitement) et de la période de traitement dans l’étude clinique APHINITY (le nombre médian de cycles de Perjeta était de 18).
* Des effets indésirables avec une issue fatale ont été rapportés.
** Pour la période totale de traitement pour les 4 études. L’incidence de dysfonction ventriculaire gauche et d’insuffisance cardiaque congestive reflète les termes privilégiés MedDRA rapportés dans les études individuelles.
° La réaction anaphylactique/d’hypersensibilité est basée sur un groupe de termes.
°° La réaction à la perfusion inclut différents termes dans un intervalle de temps, voir “ Description des effets indésirables spécifiques” ci-dessous.
† Effets indésirables rapportés depuis la commercialisation.
Description des effets indésirables spécifiques
Dysfonction ventriculaire gauche (DVG)
Dans l'étude clinique pivotale CLEOPATRA dans le cancer du sein métastatique, l'incidence de DVG au cours du traitement de l'étude a été plus élevée dans le groupe sous placebo que dans le groupe traité avec Perjeta (respectivement 8,6 % et 6,6 %). L'incidence de DVG symptomatique a également été plus faible dans le groupe traité avec Perjeta (1,8 % dans le groupe sous placebo versus [vs] 1,5 % dans le groupe traité avec Perjeta) (voir rubrique 4.4).
Dans l'étude clinique NEOSPHERE en situation néoadjuvante, au cours de laquelle les patients ont reçu 4 cycles de Perjeta en traitement néoadjuvant, l'incidence de DVG (sur la période totale de traitement) a été plus élevée dans le groupe traité avec Perjeta, le trastuzumab et le docétaxel (7,5 %) comparé au groupe traité avec le trastuzumab et le docétaxel (1,9 %). Il y a eu un cas de DVG symptomatique dans le groupe traité avec Perjeta et le trastuzumab. Dans l'étude clinique TRYPHAENA en situation néoadjuvante, l'incidence de DVG (sur la période totale de traitement) a été de 8,3 % dans le groupe traité avec Perjeta plus trastuzumab et FEC (5-flurorouracile, épirubicine, cyclophosphamide), suivi de Perjeta plus trastuzumab et docétaxel, de 9,3 % dans le groupe traité avec Perjeta plus trastuzumab et docétaxel après FEC et de 6,6 % dans le groupe traité avec Perjeta en association à TCH (docétaxel, carboplatine et trastuzumab). L'incidence de DVG symptomatique (insuffisance cardiaque congestive) a été de 1,3 % dans le groupe traité avec Perjeta plus trastuzumab et docétaxel après FEC (cela exclut un patient ayant présenté une DVG symptomatique au cours du traitement FEC avant de recevoir Perjeta plus trastuzumab et docétaxel) et également de 1,3 % dans le groupe traité avec Perjeta en association à TCH. Aucun patient du groupe traité avec Perjeta plus trastuzumab et FEC suivi de Perjeta plus trastuzumab et docétaxel n'a présenté de DVG symptomatique.
Durant la phase néoadjuvante de l’étude clinique BERENICE, l’incidence de DVG symptomatique de classe III/IV selon la classification NYHA (insuffisance cardiaque congestive selon la classification NCI-CTCAE v.4) a été de 1,5 % dans le groupe traité avec la doxorubicine et le cyclophosphamide toutes les deux semaines (chimiothérapie dose dense AC) suivi de Perjeta plus trastuzumab et paclitaxel et aucun des patients (0 %) n’a présenté de DVG symptomatique dans le groupe traité par FEC suivi par Perjeta en association au trastuzumab et au docétaxel. L’incidence de DVG asymptomatique (diminution de la fraction d’éjection selon la classification NCI-CTCAE v.4) était de 7 % dans le groupe traité avec la doxorubicine et le cyclophosphamide toutes les deux semaines (chimiothérapie dose dense AC) suivi de Perjeta plus trastuzumab et paclitaxel et de 3,5 % dans le groupe traité par FEC suivi de Perjeta plus trastuzumab et docétaxel.
Dans l’étude clinique APHINITY, l'incidence d’insuffisance cardiaque symptomatique (classe III ou IV selon la classification NYHA) associée à une diminution de la FEVG d’au moins 10 % points par rapport à la valeur initiale et jusqu’à < 50 % était < 1 % (0,8 % pour les patient traités par Perjeta vs 0,4 % pour les patients sous placebo). Parmi les patients qui ont présenté une insuffisance cardiaque symptomatique, 62,5 % de ceux traités par Perjeta et 66,7 % de ceux sous placebo se sont rétablis (le rétablissement était défini comme deux mesures consécutives de FEVG supérieures à 50 %) à la date de clôture du recueil des données. La majorité des événements ont été rapportés chez des patients traités par des anthracyclines. Des diminutions asymptomatiques ou légèrement symptomatiques (classe II selon la classification NYHA) de la FEVG d’au moins 10 % points par rapport à la valeur initiale et jusqu’à < 50 % ont été rapportées chez 2,7 % des patients traités par Perjeta et chez 2,9 % des patients sous placebo, parmi lesquels 84,4 % des patients traités par Perjeta et 87,0 % des patients sous placebo se sont rétablis à la date de clôture du recueil des données.
Réactions à la perfusion
Une réaction à la perfusion a été définie dans les études cliniques pivotales comme tout évènement rapporté comme une hypersensibilité, une réaction anaphylactique, une réaction à la perfusion aiguë ou un syndrome de relargage des cytokines survenant durant une perfusion ou le même jour que celle-ci. Dans l’étude clinique pivotale CLEOPATRA, la dose initiale de Perjeta a été administrée le jour précédant l’administration du trastuzumab et du docétaxel afin de permettre l’examen des réactions associées à Perjeta. Le premier jour au cours duquel seul Perjeta a été administré, la fréquence globale des réactions à la perfusion a été de 9,8 % dans le groupe sous placebo et de 13,2 % dans le groupe traité avec Perjeta, avec une majorité de réactions à la perfusion légères ou modérées. Les réactions à la perfusion les plus fréquentes ( 1,0 %) dans le groupe traité avec Perjeta étaient une fièvre, des frissons, une fatigue, une céphalée, une asthénie, une hypersensibilité et des vomissements.
Durant le second cycle au cours duquel tous les médicaments ont été administrés le même jour, les réactions à la perfusion les plus fréquentes ( 1,0 %) dans le groupe traité avec Perjeta étaient une fatigue, une dysgueusie, une hypersensibilité médicamenteuse, une myalgie et des vomissements (voir rubrique 4.4).
Dans les études cliniques en situation néoadjuvante et adjuvante, Perjeta a été administré le même jour que les autres traitements de l'étude lors de tous les cycles. Les réactions à la perfusion sont survenues chez 18,6 % - 25,0 % des patients lors du premier jour d’administration de Perjeta (en association au trastuzumab et à une chimiothérapie). Le type et la sévérité des événements étaient cohérents avec ceux observés dans l'étude clinique CLEOPATRA aux cycles où Perjeta était administré le même jour que le trastuzumab et le docétaxel, avec la majorité des réactions étant de sévérité légère ou modérée.
Réactions d'hypersensibilité/anaphylactiques
Dans l’étude clinique pivotale CLEOPATRA dans le cancer du sein métastatique, la fréquence globale des évènements d’hypersensibilité/anaphylactiques rapportés par l'investigateur durant la période complète de traitement a été de 9,3 % dans le groupe sous placebo et de 11,3 % dans le groupe traité avec Perjeta, dont 2,5 % et 2,0 % respectivement étaient des évènements de grade 3 - 4 selon la classification NCI-CTCAE. Au total, 2 patients dans le groupe sous placebo et 4 patients dans le groupe traité avec Perjeta ont présenté des événements décrits comme une réaction anaphylactique par l’investigateur (voir rubrique 4.4).
Globalement, la majorité des réactions d’hypersensibilité ont été d’une sévérité légère ou modérée et se sont résolues après traitement. Sur la base des modifications apportées au traitement de l’étude, la plupart des réactions ont été évaluées comme secondaires aux perfusions de docétaxel.
Dans les études cliniques en situation néoadjuvante et adjuvante, les évènements d'hypersensibilité/d’anaphylaxie étaient cohérents avec ceux observés dans l'étude clinique CLEOPATRA. Dans l'étude clinique NEOSPHERE, deux patients du groupe traité avec Perjeta et le docétaxel ont présenté une réaction anaphylactique. Dans les études cliniques TRYPHAENA et APHINITY, la fréquence globale des réactions d'hypersensibilité/anaphylactiques a été plus élevée dans le groupe traité avec Perjeta et TCH (respectivement 13,2 % et 7,6 %), dont respectivement 2,6 % et 1,3 % des événements étaient des réactions de grade 3 - 4 selon la classification NCI-CTCAE.
Neutropénie fébrile
Dans l’étude clinique pivotale CLEOPATRA, la majorité des patients dans les deux groupes de traitement ont présenté au moins une leucopénie (63,0 % des patients dans le groupe traité avec Perjeta et 58,3 % des patients dans le groupe sous placebo), dont une majorité de neutropénies (voir rubrique 4.4). Une neutropénie fébrile est survenue chez 13,7 % des patients traités avec Perjeta et 7,6 % des patients sous placebo. Dans les deux groupes de traitement, la proportion de patients présentant une neutropénie fébrile a été plus élevée au cours du premier cycle de traitement et a régulièrement diminué par la suite. Une augmentation de l’incidence des neutropénies fébriles a été observée parmi les patients asiatiques dans les deux groupes de traitement comparé aux patients d’autres origines ethniques et issus d’autres régions géographiques. Parmi les patients asiatiques, l’incidence des neutropénies fébriles a été plus élevée dans le groupe traité avec Perjeta (25,8 %) comparé au groupe sous placebo (11,3 %).
Dans l’étude clinique NEOSPHERE, 8,4 % des patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel ont présenté une neutropénie fébrile comparé à 7,5 % des patients traités avec le trastuzumab et le docétaxel. Dans l’étude clinique TRYPHAENA, une neutropénie fébrile est survenue chez 17,1 % des patients traités en néoadjuvant avec Perjeta + TCH et chez 9,3 % des patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel après FEC. Dans l’étude clinique TRYPHAENA, l’incidence de neutropénie fébrile a été plus élevée chez les patients ayant reçu six cycles de Perjeta comparé à ceux ayant reçu trois cycles de Perjeta, quelle que soit la chimiothérapie administrée. Comme dans l’étude clinique CLEOPATRA, une incidence plus élevée de neutropénie et de neutropénie fébrile a été observée parmi les patients asiatiques comparés aux autres patients dans les deux études cliniques en néoadjuvant. Dans l’étude clinique NEOSPHERE, 8,3 % des patients asiatiques traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel ont présenté une neutropénie fébrile comparé à 4,0 % des patients asiatiques traités en néoadjuvant avec le trastuzumab et le docétaxel.
Dans l’étude clinique APHINITY, une neutropénie fébrile est survenue chez 12,1 % des patients traités par Perjeta et 11,1 % des patients sous placebo. Comme dans les études cliniques CLEOPATRA, TRYPHAENA et NEOSPHERE, une incidence plus élevée de neutropénie fébrile a été observée parmi les patients asiatiques traités par Perjeta comparé aux patients d’autres origines ethniques dans l’étude clinique APHINITY (15,9 % des patients traités par Perjeta et 9,9 % des patients sous placebo).
Diarrhée
Dans l’étude pivotale CLEOPATRA dans le cancer du sein métastatique, une diarrhée est survenue chez 68,4 % des patients traités avec Perjeta et 48,7 % des patients sous placebo (voir rubrique 4.4). La majorité des évènements étaient de sévérité légère à modérée et sont survenus au cours des premiers cycles de traitement. L’incidence des diarrhées de grade 3 - 4 selon la classification NCI-CTCAE a été de 9,3 % chez les patients traités avec Perjeta vs 5,1 % chez les patients sous placebo. La durée médiane de l’épisode le plus long a été de 18 jours chez les patients traités avec Perjeta et de 8 jours chez les patients sous placebo. Les diarrhées ont bien répondu à un traitement symptomatique précoce avec des anti-diarrhéiques.
Dans l’étude clinique NEOSPHERE, une diarrhée est survenue chez 45,8 % des patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel comparé à 33,6 % des patients traités avec le trastuzumab et le docétaxel. Dans l’étude clinique TRYPHAENA, une diarrhée est survenue chez 72,3 % des patients traités en néoadjuvant avec Perjeta + TCH et chez 61,4 % des patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel après FEC. Dans les deux études cliniques, la plupart des événements étaient de sévérité légère à modérée.
Dans l’étude clinique APHINITY, une incidence plus élevée de diarrhées a été rapportée dans le bras traité par Perjeta (71,2 %) comparé au bras sous placebo (45,2 %). Une diarrhée de grade ≥ 3 a été rapportée chez 9,8 % des patients dans le bras Perjeta vs 3,7 % dans le bras placebo. La majorité des événements rapportés étaient d’une sévérité de grade 1 ou 2. L’incidence la plus élevée de diarrhées (tous grades confondus) a été rapportée lors de la période de thérapie ciblée associée à une chimiothérapie à base de taxane (61,4 % des patients du bras Perjeta vs 33,8 % des patients du bras placebo). L’incidence des diarrhées était beaucoup plus faible après arrêt de la chimiothérapie, affectant 18,1 % des patients du bras Perjeta vs 9,2 % des patients du bras placebo lors de la période de thérapie ciblée post-chimiothérapie.
Rash
Dans l’étude clinique pivotale CLEOPATRA dans le cancer du sein métastatique, un rash est survenu chez 51,7 % des patients traités avec Perjeta, comparé à 38,9 % des patients sous placebo. Les évènements étaient, dans leur majorité d’une sévérité de grade 1 ou 2, sont survenus au cours des deux premiers cycles et ont répondu aux traitements standards, tels qu’un traitement antiacnéique local ou oral.
Dans l’étude clinique NEOSPHERE, un rash est survenu chez 40,2 % des patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel comparé à 29,0 % des patients traités avec le trastuzumab et le docétaxel. Dans l’étude clinique TRYPHAENA, un rash est survenu chez 36,8 % des patients traités en néoadjuvant avec Perjeta + TCH et chez 20,0 % des patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel après FEC. L’incidence de rash était plus élevée chez les patients ayant reçu six cycles de Perjeta comparé aux patients ayant reçu trois cycles de Perjeta, quelle que soit la chimiothérapie administrée.
Dans l’étude clinique APHINITY, un rash est survenu chez 25,8 % des patients du bras Perjeta vs 20,3 % des patients du bras placebo. La majorité des cas de rash étaient de grade 1 ou 2.
Anomalies biologiques
Dans l’étude clinique pivotale CLEOPATRA dans le cancer du sein métastatique, l’incidence des neutropénies de grade 3 - 4 selon la classification NCI-CTCAE v.3 était équilibrée dans les deux groupes de traitement (86,3 % des patients traités avec Perjeta et 86,6 % des patients sous placebo, dont respectivement 60,7 % et 64,8 % de neutropénies de grade 4).
Dans l’étude clinique NEOSPHERE, l’incidence des neutropénies de grade 3 - 4 selon la classification NCI-CTCAE v.3 était de 74,5 % chez les patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel comparé à 84,5 % des patients traités avec le trastuzumab et le docétaxel, dont respectivement 50,9 % et 60,2 % de neutropénies de grade 4. Dans l’étude clinique TRYPHAENA, l’incidence des neutropénies de grade 3 - 4 selon la classification NCI-CTCAE v.3 était de 85,3 % chez les patients traités en néoadjuvant avec Perjeta + TCH et de 77,0 % chez les patients traités en néoadjuvant avec Perjeta, le trastuzumab et le docétaxel après FEC, dont respectivement 66,7 % et 59,5 % de neutropénies de grade 4.
Dans l’étude clinique APHINITY, l’incidence des neutropénies de grade 3 - 4 selon la classification NCI-CTCAE v.4 était de 40,6 % chez les patients traités par Perjeta, le trastuzumab et une chimiothérapie comparé à 39,1 % chez les patients traités par un placebo, le trastuzumab et une chimiothérapie, dont respectivement 28,3 % et 26,5 % de neutropénies de grade 4.
Patients âgés
L'incidence des événements indésirables suivants, tous grades confondus, était plus élevée d’au moins 5 % chez les patients âgés de 65 ans et plus, par rapport aux patients âgés de moins de 65 ans : appétit diminué, anémie, perte de poids, asthénie, dysgueusie, neuropathie périphérique, hypomagnésémie et diarrhée. Des données limitées sont disponibles chez les patients âgés de plus de 75 ans.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir ci-dessous).
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/13/813/001
10. DATE DE MISE À JOUR DU TEXTE
8 mai 2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3019890 | PERJETA 420MG SOL DIL PERF FL INJ 1 X 14ML | L01FD02 | - | € 1900,77 | Oui | - | - |