RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
NeoRecormon 500 UI solution injectable en seringue préremplie
NeoRecormon 2 000 UI solution injectable en seringue préremplie
NeoRecormon 3 000 UI solution injectable en seringue préremplie
NeoRecormon 4 000 UI solution injectable en seringue préremplie
NeoRecormon 5 000 UI solution injectable en seringue préremplie
NeoRecormon 6 000 UI solution injectable en seringue préremplie
NeoRecormon 10 000 UI solution injectable en seringue préremplie
NeoRecormon 20 000 UI solution injectable en seringue préremplie
NeoRecormon 30 000 UI solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
NeoRecormon 500 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,3 ml de solution injectable contient 500 unités internationales (UI) correspondant à 4,15 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 1 667 UI d’époétine bêta.
NeoRecormon 2 000 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,3 ml de solution injectable contient 2 000 unités internationales (UI) correspondant à 16,6 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 6 667 UI d’époétine bêta.
NeoRecormon 3 000 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,3 ml de solution injectable contient 3 000 unités internationales (UI) correspondant à 24,9 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 10 000 UI d’époétine bêta.
NeoRecormon 4 000 UI solution injectable en seringue préremplie
Une seringue pré-remplie de 0,3 ml de solution injectable contient 4 000 unités internationales (UI) correspondant à 33,2 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 13 333 UI d’époétine bêta.
NeoRecormon 5 000 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,3 ml de solution injectable contient 5 000 unités internationales (UI) correspondant à 41,5 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 16 667 UI d’époétine bêta.
NeoRecormon 6 000 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,3 ml de solution injectable contient 6 000 unités internationales (UI) correspondant à 49,8 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 20 000 UI d’époétine bêta.
NeoRecormon 10 000 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,6 ml de solution injectable contient 10 000 unités internationales (UI) correspondant à 83 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 16 667 UI d’époétinebêta.
NeoRecormon 20 000 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,6 ml de solution injectable contient 20 000 unités internationales (UI) correspondant à 166 microgrammes d'époétine bêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 33 333 UI d’époétine bêta.
NeoRecormon 30 000 UI solution injectable en seringue préremplie
Une seringue préremplie de 0,6 ml de solution injectable contient 30 000 unités internationales (UI)
correspondant à 250 microgrammes d'époétinebêta* (érythropoïétine humaine recombinante).
Un ml de solution injectable contient 50 000 UI d’époétine bêta.
* produite sur une lignée de cellules d’Ovaire de Hamster Chinois (CHO) par la technique de l'ADN recombinante.
Excipient(s) à effet notoire
Phenylalanine (jusqu’à 0,3 mg/seringue)
Sodium (moins de 1 mmol/seringue)
Polysorbate 20 (0,034 mg/seringue pour un volume nominal de 0,3 ml et 0,063 mg/seringue pour un volume nominal de 0,6 ml)
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable.
Solution incolore, transparente à légèrement opalescente.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
NeoRecormon est indiqué dans :
- le traitement de l'anémie symptomatique associée à l’insuffisance rénale chronique chez l’adulte et l’enfant.
- la prévention de l'anémie du nouveau-né prématuré, de poids de naissance compris entre 750 et 1 500 g et dont l'âge gestationnel est inférieur à 34 semaines.
- le traitement de l’anémie symptomatique des patients adultes atteints de tumeurs malignes non myéloïdes et traités par chimiothérapie.
- l’augmentation du volume des dons de sang autologue chez des malades participant à un programme de transfusions autologues différées.
L’utilisation dans cette indication doit tenir compte du risque accru d’accidents thrombo-emboliques. Le traitement ne doit être administré qu’à des malades présentant une anémie modérée (Hb 10 ‑ 13 g/dl soit 6,21 ‑ 8,07 mmol/l et sans carence martiale), s'il n’existe pas ou peu de méthodes de récupération du sang lorsqu'une intervention chirurgicale programmée importante nécessite de grandes quantités de sang (4 unités de sang ou plus chez les femmes et 5 unités de sang ou plus chez les hommes). Voir rubrique 5.1.
4.2 Posologie et mode d'administration
L’initiation du traitement par NeoRecormon relève de praticiens expérimentés dans les domaines thérapeutiques cités ci-dessus. En raison de réactions anaphylactoïdes observées dans des cas isolés, il est recommandé d'administrer la première dose du produit sous surveillance médicale.
Posologie
Traitement de l'anémie symptomatique de l'insuffisance rénale chronique chez l’adulte et l’enfant
Les symptômes et les séquelles de l’anémie pouvant varier avec l'âge, le sexe et la gravité globale de la maladie, une évaluation au cas par cas de l’évolution clinique et de l’état du patient par un médecin est nécessaire. NeoRecormon doit être administré par voie sous-cutanée ou intraveineuse pour atteindre un taux d’hémoglobine inférieur ou égal à 12 g/dl (7,45 mmol/l). La voie sous-cutanée est préférable chez les patients non hémodialysés, pour préserver les veines périphériques.
En cas d'administration intraveineuse, la solution doit être injectée en 2 minutes environ, par exemple chez les malades hémodialysés via la fistule artério-veineuse en fin de dialyse.
En raison de la variabilité intra-patient, le taux d’hémoglobine observé peut parfois être supérieur ou inférieur à celui souhaité chez un patient donné. La variabilité du taux d’hémoglobine doit être prise en charge par une adaptation posologique destinée à maintenir le taux d’hémoglobine cible, compris entre 10 g/dl (6,21 mmol/l) et 12 g/dl (7,45 mmol/l). Un taux d’hémoglobine supérieur à 12 g/dl (7,45 mmol/l) doit être évité sur une période prolongée; les recommandations relatives à l’adaptation posologique appropriée lorsque le taux d’hémoglobine observé est supérieur à 12 g/dl (7,45 mmol/l) sont décrites ci-dessous.
Toute augmentation du taux d’hémoglobine de plus de 2 g/dl (1,25 mmol/l) sur une période de quatre semaines doit être évitée. Si elle se produit, une adaptation posologique appropriée doit être instaurée.
Si l’augmentation du taux d’hémoglobine est supérieure à 2 g/dl (1,25 mmol/l) en un mois ou si le taux d’hémoglobine augmente pour approcher 12 g/dl (7,45 mmol/l), la dose doit être réduite d’environ 25%. Si le taux d’hémoglobine continue d’augmenter, le traitement doit être interrompu jusqu’à ce que le taux d’hémoglobine redescende, puis le traitement doit être repris à une dose réduite d’environ 25% par rapport à la dose précédemment administrée.
Les patients doivent faire l’objet d’une surveillance étroite afin de s’assurer que la dose efficace la plus faible approuvée de NeoRecormon est utilisée pour permettre un contrôle satisfaisant des symptômes de l’anémie, tout en maintenant un taux d'hémoglobine inférieur ou égal à 12 g/dl (7,45 mmol/l).
La prudence s’impose lors de l’escalade de dose de NeoRecormon chez les patients atteints d'insuffisance rénale chronique. Chez les patients présentant une réponse faible du taux d'hémoglobine au NeoRecormon, d'autres facteurs expliquant la faible réponse devront être envisagés (voir rubriques 4.4 et 5.1).
En présence d'une hypertension ou de pathologies cardiovasculaires, vasculaires cérébrales ou vasculaires périphériques préexistantes, la valeur de l'hémoglobine à atteindre ainsi que l'augmentation hebdomadaire de l'hémoglobine doivent être déterminées individuellement selon le tableau clinique.
Le traitement par NeoRecormon est divisé en deux phases :
1. Phase de correction
- Administration sous-cutanée :
La posologie initiale est de 3 x 20 UI/kg et par semaine. La posologie peut être augmentée toutes les 4 semaines de 3 x 20 UI/kg et par semaine, si l'augmentation de l'hémoglobine n'est pas satisfaisante (< 0,25 g/dl par semaine).
La posologie hebdomadaire peut aussi être divisée en doses quotidiennes.
- Administration intraveineuse :
La posologie initiale est de 40 UI/kg, 3 fois par semaine. Après 4 semaines la posologie peut être augmentée à 80 UI/kg, 3 fois par semaine, et, si nécessaire, par de nouvelles augmentations de doses de 20 UI/kg, 3 fois par semaine, à un mois d'intervalle.
Pour les deux voies d'administration, la dose maximale ne doit pas dépasser 720 UI/kg et par semaine.
2. Phase d'entretien
Pour maintenir l'hémoglobine entre 10 et 12 g/dl, la posologie est d'abord réduite de moitié par rapport à la dernière dose administrée. Celle-ci est ensuite ajustée à intervalles de une ou deux semaines pour chaque malade (dose d'entretien).
Dans le cas d'une administration par voie sous cutanée, la dose hebdomadaire peut être administrée en une injection par semaine ou répartie en 3 ou 7 injections par semaine. Les patients stables sous un rythme d'administration d'une injection par semaine peuvent passer à une injection toutes les deux semaines. Dans ce cas, une augmentation de la dose peut être nécessaire.
Chez les enfants, les essais cliniques ont montré que les doses de NeoRecormon nécessaires sont d'autant plus élevées que le sujet est jeune. Cependant, sachant que l'on ne peut préjuger de la réponse individuelle, il convient de respecter le schéma posologique recommandé.
Le traitement par NeoRecormon est normalement un traitement au long cours. Toutefois il peut être interrompu à tout moment, si cela paraît nécessaire. Les données concernant le schéma posologique pour une injection par semaine sont basées sur des études cliniques dont la durée de traitement est de 24 semaines.
Prévention de l'anémie du nouveau-né prématuré
La solution est administrée par voie sous-cutanée à une dose de 250 UI/kg, 3 fois par semaine. Les nouveau-nés prématurés qui ont déjà été transfusés au moment de l'initiation du traitement par NeoRecormon ne sont pas susceptibles de retirer autant de bénéfice du traitement que les nouveau-nés n’ayant jamais été transfusés. La durée du traitement recommandée est de 6 semaines..
Traitement de l’anémie symptomatique induite par la chimiothérapie chez les patients cancéreux
NeoRecormon doit être administré par voie sous-cutanée chez les patients anémiques (par ex. taux d’hémoglobine ≤ 10 g/dl (6,21 mmol/l)). Les symptômes et les séquelles de l’anémie pouvant varier avec l'âge, le sexe et la gravité globale de la maladie, une évaluation au cas par cas de l’évolution clinique et de l’état du patient par un médecin est nécessaire.
La dose hebdomadaire peut être administrée en une injection par semaine ou répartie en 3 à 7 injections par semaine.
La dose initiale recommandée est de 30 000 UI par semaine (correspondant à environ 450 UI/kg et par semaine, calculé sur la base d’un poids corporel patient moyen).
En raison de la variabilité intra-patient, le taux d’hémoglobine observé peut parfois être supérieur ou inférieur à celui souhaité chez un patient donné. La variabilité du taux d’hémoglobine doit être prise en charge par une adaptation posologique destinée à maintenir le taux d’hémoglobine cible, compris entre 10 g/dl (6,21 mmol/l) et 12 g/dl (7,45 mmol/l). Un taux d’hémoglobine supérieur à 12 g/dl (7,45 mmol/l) doit être évité sur une période prolongée ; les recommandations relatives à l’adaptation posologique appropriée lorsque le taux d’hémoglobine observé est supérieur à 12 g/dl (7,45 mmol/l) sont décrites ci-dessous.
Si, après 4 semaines de traitement, le taux d’hémoglobine a augmenté d’au moins 1 g/dl (0,62 mmol/l), la dose choisie doit être poursuivie. Si le taux d’hémoglobine n’a pas augmenté d’au moins 1 g/dl (0,62 mmol/l), un doublement de la dose doit être considéré. Si après 8 semaines de traitement, le taux d’hémoglobine n’a pas augmenté d’au moins 1 g/dl (0,62 mmol/l), une réponse est peu probable et le traitement doit être interrompu.
Le traitement doit être poursuivi jusqu’à 4 semaines après la fin de la chimiothérapie.
La dose maximale ne doit pas dépasser 60 000 UI par semaine.
Une fois que l’objectif thérapeutique a été atteint pour le patient, la dose doit être réduite de 25 à 50 % de façon à maintenir l’hémoglobine à ce niveau. Une adaptation posologique appropriée doit être envisagée.
Si le taux d’hémoglobine dépasse 12 g/dl (7,45 mmol/l), la dose doit être réduite d’environ 25 à 50 %. Le traitement par NeoRecormon doit être temporairement interrompu si le taux d’hémoglobine dépasse 13 g/dl (8,1 mmol/l). Le traitement doit être repris à une dose d’environ 25 % inférieure à la dose précédente, après que le taux d’hémoglobine soit devenu inférieur ou égal à 12 g/dl (7,45 mmol/l).
Si l'hémoglobine augmente de plus de 2 g/dl (1,3 mmol/l) en 4 semaines, la dose doit être réduite de 25 à 50 %.
Les patients doivent faire l’objet d’une surveillance étroite afin de s’assurer que la dose la plus faible approuvée de NeoRecormon est utilisée pour permettre un contrôle satisfaisant des symptômes de l’anémie.
Augmentation du volume des dons de sang autologue
La solution est administrée soit par voie intraveineuse en 2 minutes environ soit par voie sous-cutanée.
NeoRecormon est administré 2 fois par semaine pendant 4 semaines. Lorsque l'hématocrite du malade permet un don de sang (hématocrite 33 %), NeoRecormon est administré à la fin du don.
Pendant toute la durée du traitement, l'hématocrite ne doit pas dépasser 48 %.
La posologie doit être établie pour chaque malade par l'équipe médico-chirurgicale en fonction de la prévision du nombre d’unités autologues nécessaires et de la réserve globulaire endogène :
1. Le nombre d’unités autologues nécessaires dépend de la perte sanguine anticipée, de l'emploi de méthodes d'épargne sanguine ainsi que de l'état général du malade.
Cette quantité correspond à la quantité supposée être suffisante pour éviter les transfusions homologues.
La quantité requise de sang autologue est exprimée en unités, une unité du nomogramme correspond à 180 ml de globules rouges.
2. La capacité du malade à fournir des dons autologues dépend essentiellement du volume sanguin et de l'hématocrite initial. Ces deux paramètres déterminent la réserve globulaire endogène qui peut être calculée d'après la formule suivante :
Réserve globulaire endogène = volume sanguin (ml) x (hématocrite - 33) : 100
Chez la femme : volume sanguin (ml) = 41 (ml/kg) x poids (kg) + 1 200 (ml)
Chez l'homme : volume sanguin (ml) = 44 (ml/kg) x poids (kg) + 1 600 (ml)
(poids corporel > 45 kg).
L’indication du traitement par NeoRecormon, et, si celle-ci est posée, les doses unitaires doivent être déterminées en fonction de la quantité nécessaire de sang autologue et de la réserve globulaire endogène à l'aide des graphiques suivants :
Femmes Hommes
Nombre d’unités autologues Nombre d’unités autologues
nécessaires nécessaires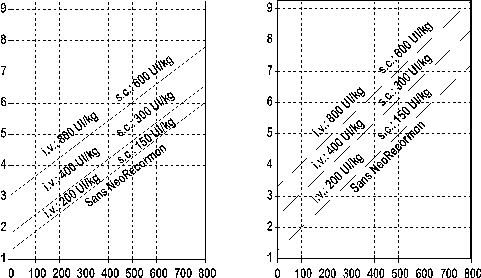
Réserve globulaire endogène [ml] Réserve globulaire endogène [ml]
La dose unitaire ainsi déterminée doit être administrée 2 fois par semaine pendant 4 semaines. La posologie maximale ne doit pas dépasser 1 600 UI/kg/semaine pour la voie intraveineuse, et 1 200 UI/kg/semaine pour la voie sous-cutanée.
Mode d’administration
La seringue préremplie de NeoRecormon est prête à l’emploi. Seules les solutions transparentes ou légèrement opalescentes, incolores et pratiquement sans particules visibles à l'œil nu peuvent être injectées.
NeoRecormon en seringue préremplie est un produit stérile mais sans conservateur, raison pour laquelle on ne doit en aucun cas administrer plusieurs doses à l’aide d’une même seringue ; ce médicament est à usage unique.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients listés à la rubrique 6.1.
Hypertension artérielle mal contrôlée
Dans l’indication “augmentation du volume des dons de sang autologue” : infarctus du myocarde ou accident vasculaire cérébral le mois précédant le traitement, angor instable, patients à risque de thromboses veineuses profondes tels que ceux ayant des antécédents thrombo-emboliques.
4.8 Effets indésirables
Résumé du profil de tolérance
Les résultats d'études cliniques incluant 1 725 patients montrent qu'environ 8 % des patients traités par NeoRecormon sont susceptibles de présenter des effets indésirables.
Malades présentant une insuffisance rénale chronique accompagnée d'une anémie
L'effet indésirable le plus fréquent lors du traitement par NeoRecormon est une augmentation de la pression artérielle ou l'aggravation d'une hypertension préexistante, surtout en cas d'élévation rapide de l'hématocrite (voir rubrique 4.4). Des crises hypertensives avec signes de type encéphalopathie tels que céphalées et états confusionnels, signes sensoriels et moteurs tels que des troubles de l'élocution ou de l'équilibre, voire convulsions peuvent également survenir, chez des malades habituellement normo- ou hypotendus (voir rubrique 4.4).
Une thrombose de la fistule artério-veineuse peut survenir, en particulier chez les malades hypotendus ou dont la fistule présente des complications (sténose ou anévrisme), voir rubrique 4.4. Dans la majorité des cas, on observe une baisse de la ferritinémie de façon concomitante à l'élévation de l'hématocrite (voir rubrique 4.4). De plus, une élévation transitoire de la kaliémie et de la phosphatémie a pu être observée dans des cas isolés (voir rubrique 4.4).
Des cas isolés d’érythroblastopénie, dus à des anticorps neutralisants dirigés contre l’érythropoïétine ont été rapportés après un traitement par NeoRecormon. Si un cas d’érythroblastopénie est diagnostiqué, le traitement par NeoRecormon doit être interrompu et un traitement par une autre érythropoïétine recombinante ne doit pas être instauré (voir rubrique 4.4).
Les effets indésirables sont listés dans le tableau 1 ci-dessous.
Patients atteints de cancer
Des céphalées et une hypertension artérielle liées au traitement par époétine bêta et pouvant être contrôlées par traitement médicamenteux sont fréquentes (voir rubrique 4.4).
Chez certains patients, une diminution des paramètres réfletant le statut martial est observée (voir rubrique 4.4).
Dans les études cliniques, la fréquence d’accidents thromboemboliques était supérieure chez les patients atteints de cancer traités par NeoRecormon comparé au groupe non traité ou placebo. Chez les patients traités par NeoRecormon, cette incidence est de 7 % par rapport à 4 % dans le groupe contrôle ; ceci n’est accompagné d’aucune augmentation de la mortalité thromboembolique par rapport au groupe contrôle.
Les effets indésirables sont listés dans le tableau 2. ci-dessous.
Malades inclus dans un programme de transfusions autologues
On a rapporté chez des patients inclus dans un programme de transfusions autologues une fréquence légèrement supérieure d’accidents thrombo-emboliques. Cependant, aucune relation avec le traitement par NeoRecormon n’a été établie.
Au cours des essais cliniques contrôlés versus placebo, la carence martiale temporaire était plus prononcée chez les patients traités par NeoRecormon que dans le groupe contrôle (voir rubrique 4.4).
Les effets indésirables sont listés dans le tableau 3 ci-dessous.
Des réactions indésirables cutanées sévères (SCAR), dont le syndrome de Stevens-Johnson (SSJ) et le
syndrome de Lyell, pouvant engager le pronostic vital ou être fatales ont été rapportées dans le cadre
de traitements à base d’époétine (voir rubrique 4.4).
Liste tabulée des effets indésirables
Les effets indésirables sont listés ci-dessous par système organe-classe MedDRA et catégorie de fréquence. La convention suivante a été utilisée pour la classification des fréquences :
très fréquent ( ≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent ( ≥ 1/1 000 à < 1/100) ; rare ≥ (1/10 000 à 1/1 000) ; très rare (< 1/10 000) ; indéterminée (ne peut être déterminée sur la base des données disponibles).
Tableau 1 : Effets indésirables attribués à un traitement par NeoRecormon issus des essais cliniques conduits chez des patients atteints d’insuffisance rénale chronique
Système Organe Classe | Effet indésirable | Fréquence |
Affections vasculaires | Hypertension artérielle | Fréquente |
Affections du système nerveux | Céphalée | Fréquente |
Affections hématologiques et du système lymphatique | Thrombose de la fistule artério-veineuse | Rare |
Tableau 2 : Effets indésirables attribués à un traitement par NeoRecormon issus des essais cliniques conduits chez des patients atteints de cancer
Système Organe Classe | Effet indésirable | Fréquence |
Affections vasculaires | Hypertension artérielle | Fréquente |
Affections hématologiques et du système lymphatique | Evénement thromboembolique | Fréquente |
Affections du système nerveux | Céphalée | Fréquente |
Tableau 3 : Effets indésirables attribués à un traitement par NeoRecormon issus des essais cliniques conduits chez des malades inclus dans un programme de transfusions autologues
Système Organe Classe | Effet indésirable | Fréquence |
Affections du système nerveux | Céphalée | Fréquente |
Prématurés
Une diminution de la ferritinémie est très fréquente (voir rubrique 4.4).
Description des effets indésirables sélectionnés
De rares réactions cutanées liées au traitement par époétine bêta, comme éruption, prurit, urticaire ou réaction au point d’injection peuvent survenir. De très rares cas de réactions anaphylactoïdes liées au traitement par époétine bêtaont été rapportés. Cependant aucune augmentation de l’incidence des réactions d’hypersensibilité n’a été trouvée au cours des essais cliniques contrôlés.
Dans de très rares cas , des symptômes pseudo-grippaux liés au traitement par époétine bêtatels que fièvre, frissons, maux de tête, douleur dans les membres, malaise et/ou douleur osseuse ont été rapportés, en particulier en début de traitement. Ces réactions étaient légères à modérées et disparaissaient dans les quelques heures ou jours suivants.
Les données d’un essai clinique conduit avec l’ époétine alfa et la darbépoétine alfa ont rapporté une incidence fréquente d’accidents vasculaires cérébraux .
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir ci-dessous).
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
8. NUMEROS D’AUTORISATION DE MISE SUR LE MARCHE
EU/1/97/031/025-026
EU/1/97/031/029-030
EU/1/97/031/031-032
EU/1/97/031/033‑034
EU/1/97/031/035‑036
EU/1/97/031/037-038
EU/1/97/031/041-042
EU/1/97/031/043-044
EU/1/97/031/045-046
10. DATE DE MISE À JOUR DU TEXTE
1 mai 2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne du médicament http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1478130 | NEORECORMON 500 UI SER PREREMPL 6 | B03XA01 | - | € 23,49 | Oui | - | - |
| 1478155 | NEORECORMON 2000 UI SER PREREMPL 6 | B03XA01 | - | € 93,96 | Oui | - | - |
| 1478163 | NEORECORMON 3000 UI SER PREREMPL 6 | B03XA01 | - | € 140,94 | Oui | - | - |
| 1478171 | NEORECORMON 5000 UI SER PREREMPL 6 | B03XA01 | - | € 224,27 | Oui | - | - |
| 1478189 | NEORECORMON 10000 UI SER PREREMPL 6 | B03XA01 | - | € 448,53 | Oui | - | - |
| 1522390 | NEORECORMON 6000 UI SER PREREMPL 6 | B03XA01 | - | € 269,11 | Oui | - | - |
| 1522408 | NEORECORMON 4000 UI SER PREREMPL 6 | B03XA01 | - | € 179,41 | Oui | - | - |
| 2084390 | NEORECORMON 30000 UI SER PREREMPL 4 | B03XA01 | - | € 897,06 | Oui | - | - |