- Aperçu notices
- Notice
Notice : Information du patient
Ocrevus 300 mg, solution à diluer pour perfusion
ocrelizumab
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
Gardez cette notice. Vous pourriez avoir besoin de la relire.
Si vous avez d’autres questions, interrogez votre médecin.
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Que contient cette notice ?
1. QU’EST-CE QU’OCREVUS ET DANS QUEL CAS EST-IL UTILISÉ
Qu’est-ce qu’Ocrevus
Ocrevus contient la substance active « ocrelizumab ». C’est un type de protéine appelée « anticorps monoclonal ». Les anticorps agissent en se liant à des cibles spécifiques dans votre corps.
Dans quel cas est-il utilisé
Ocrevus est utilisé pour traiter les patients adultes atteints de :
Sclérose en plaques récurrente (SEP-R)
Sclérose en plaques primaire progressive (SEP-PP) à un stade précoce de la maladie
Qu’est-ce que la sclérose en plaques
La sclérose en plaques (SEP) touche le système nerveux central, particulièrement les nerfs dans le cerveau et la moelle épinière. Dans la SEP, le système immunitaire (système de défense de votre corps) fonctionne anormalement et attaque une couche protectrice (appelée gaine de myéline) autour de vos cellules nerveuses et provoque une inflammation. La dégradation de la gaine de myéline empêche les nerfs de fonctionner correctement.
Les symptômes de la SEP dépendent de la partie du système nerveux central qui est affectée et peuvent inclure des problèmes de marche et d’équilibre, une faiblesse, un engourdissement, une vision double et floue, une mauvaise coordination et des troubles urinaires.
Dans la SEP récurrente, le patient présente des crises répétées de symptômes (poussées). Les symptômes peuvent survenir brutalement dans un délai de quelques heures, ou lentement sur plusieurs jours. Les symptômes disparaissent ou s’améliorent entre les poussées mais des lésions peuvent s’accumuler et déboucher sur un handicap permanent.
Dans la SEP primaire progressive, les symptômes s’aggravent généralement de manière continue dès le début de la maladie.
Comment Ocrevus agit-il ?
Ocrevus se lie à des lymphocytes B spécifiques, qui sont un type de globules blancs faisant partie du système immunitaire et qui jouent un rôle dans la SEP. Ocrevus cible et élimine ces lymphocytes B spécifiques. Ceci réduit l’inflammation et la dégradation de la gaine de myéline, réduit le risque d’avoir une poussée et ralentit la progression de votre maladie.
Dans la SEP récurrente (SEP-R), Ocrevus contribue à réduire significativement le nombre de poussées et à ralentir significativement la progression de la maladie. Ocrevus augmente également de manière significative la probabilité qu’un patient ait une absence de signe d’activité de la maladie (lésions cérébrales, poussées et aggravation du handicap).
Dans la SEP primaire progressive (SEP-PP), Ocrevus contribue à ralentir la progression de la maladie et à réduire la détérioration de la vitesse de marche.
2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT D’UTILISER OCREVUS
N’utilisez jamais Ocrevus :
si vous êtes allergique à ocrelizumab ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
si vous avez actuellement une infection.
si l’on vous a informé que vous avez de graves problèmes avec votre système immunitaire.
si vous avez un cancer.
En cas de doute, adressez-vous à votre médecin avant de recevoir Ocrevus.
Avertissements et précautions
Adressez-vous à votre médecin avant de recevoir Ocrevus si vous êtes concernés par l’une des situations suivantes. Votre médecin peut décider de reporter votre traitement par Ocrevus ou il peut décider de ne pas vous administrer Ocrevus dans les cas suivants :
Vous avez une infection. Votre médecin attendra la résolution de l’infection avant de vous administrer Ocrevus.
Vous avez déjà eu une hépatite B ou vous êtes porteur du virus de l’hépatite B. En effet, des médicaments comme Ocrevus peuvent entraîner une réactivation du virus de l’hépatite B. Avant votre traitement par Ocrevus, votre médecin vérifiera si vous présentez un risque d’avoir une hépatite B. Les patients qui ont eu une hépatite B ou qui sont porteurs du virus de l’hépatite B auront un examen sanguin et seront surveillés par un médecin afin de détecter les signes d’hépatite B.
Vous avez un cancer ou vous avez eu un cancer par le passé. Votre médecin peut décider de reporter votre traitement par Ocrevus.
Effets sur le système immunitaire :
Maladies qui affectent votre système immunitaire : si vous avez une autre maladie qui affecte le système immunitaire. Vous pourriez ne pas pouvoir recevoir Ocrevus.
Médicaments qui affectent votre système immunitaire : si vous avez déjà pris, prenez ou pourriez prendre des médicaments qui affectent le système immunitaire tels qu’une chimiothérapie, des immunosuppresseurs ou d’autres médicaments utilisés pour traiter la SEP. Votre médecin peut décider de reporter votre traitement par Ocrevus ou il peut vous demander d’arrêter ce type de médicaments avant de commencer le traitement par Ocrevus. Voir rubrique ci-dessous « Autres médicaments et Ocrevus » pour plus d’informations.
Réactions associées à la perfusion
Les réactions associées à la perfusion sont l’effet indésirable le plus fréquent du traitement par Ocrevus.
Informez immédiatement votre médecin ou votre infirmier/ère si vous présentez une réaction associée à la perfusion (voir rubrique 4 pour la liste des réactions associées à la perfusion). Les réactions associées à la perfusion peuvent survenir pendant la perfusion ou jusqu’à 24 heures après la perfusion.
Pour réduire le risque de réactions associées à la perfusion, votre médecin vous donnera d’autres médicaments à prendre avant chaque perfusion d’Ocrevus (voir rubrique 3) et vous serez surveillé étroitement pendant la perfusion et pendant au moins 1 heure après la perfusion.
Infections
Si vous pensez avoir une infection, prévenez votre médecin avant de recevoir Ocrevus. Votre médecin attendra que l’infection soit résolue avant de vous administrer Ocrevus.
Vous pourriez contracter plus facilement des infections lors du traitement par Ocrevus. En effet, les cellules immunitaires ciblées par Ocrevus contribuent aussi à combattre les infections.
Avant de débuter votre traitement par Ocrevus et avant toute perfusion, votre médecin peut vous demander de réaliser des tests sanguins afin de vérifier votre système immunitaire car des infections peuvent survenir plus fréquemment si vous avez de graves problèmes avec votre système immunitaire.
Si vous êtes traités par Ocrevus pour une sclérose en plaques primaire progressive, et que vous avez des difficultés à avaler, Ocrevus peut augmenter le risque de pneumonie sévère.
Informez immédiatement votre médecin ou votre infirmier/ère si vous présentez l’un de ces signes d’infection pendant ou après le traitement par Ocrevus :
- fièvre ou frissons
- toux qui ne disparaît pas
- herpès (comme un bouton de fièvre, un zona ou un herpès génital).
Informez immédiatement votre médecin ou votre infirmier/ère si vous pensez que votre SEP s’aggrave ou si vous remarquez un nouveau symptôme. En effet, il existe une infection cérébrale très rare mais qui engage le pronostic vital, appelée « leucoencéphalopathie multifocale progressive » (LEMP), qui peut provoquer des symptômes similaires à ceux de la SEP. Des cas de LEMP peuvent survenir chez des patients prenant Ocrevus.
Informez votre partenaire ou votre aidant de votre traitement par Ocrevus. Ils pourraient remarquer des symptômes de LEMP que vous-même ne remarquez pas, comme des pertes de mémoire, des troubles de la pensée, des difficultés à marcher, une perte de la vision, des modifications de la façon dont vous parlez, que votre médecin pourrait juger nécessaires d’évaluer.
Vaccins
Informez votre médecin si vous avez récemment reçu un vaccin ou pourriez recevoir un vaccin dans un futur proche.
Pendant votre traitement par Ocrevus, vous ne devez pas recevoir de vaccins « vivants » ou « vivants atténués » (par exemple BCG contre la tuberculose ou vaccins contre la fièvre jaune).
Il se peut que votre médecin vous recommande de vous faire vacciner contre la grippe saisonnière.
Votre médecin vérifiera si vous avez besoin de vaccins avant le début du traitement par Ocrevus. Les vaccins doivent être administrés au moins 6 semaines avant le début du traitement par Ocrevus.
Enfants et adolescents
Ocrevus n’est pas indiqué chez les enfants et les adolescents de moins de 18 ans car ses effets n’ont pas été étudiés chez des patients de cette tranche d’âge.
Autres médicaments et Ocrevus
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Informez en particulier votre médecin dans les situations suivantes :
vous avez récemment pris, prenez ou pourriez prendre des médicaments qui affectent le système immunitaire – tels que chimiothérapie, immunosuppresseurs ou autres médicaments pour traiter la SEP. L’effet de ces autres médicaments associés à Ocrevus sur le système immunitaire pourrait être trop fort. Votre médecin peut décider de reporter votre traitement par Ocrevus ou il peut vous demander d’arrêter ces médicaments avant de commencer le traitement par Ocrevus.
vous prenez des médicaments contre l’hypertension artérielle. En effet, Ocrevus pourrait diminuer la pression artérielle. Votre médecin pourrait vous demander d’arrêter de prendre vos médicaments contre l’hypertension artérielle pendant 12 heures avant chaque perfusion d’Ocrevus.
Si vous êtes dans l’une des situations ci-dessus (ou en cas de doute), adressez-vous à votre médecin avant de recevoir Ocrevus.
Grossesse
Si vous êtes enceinte, si vous pensez que vous pouvez être enceinte ou si vous planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament. En effet, Ocrevus pourrait traverser la barrière placentaire et affecter votre bébé.
Vous ne devez pas utiliser Ocrevus si vous êtes enceinte, sauf si vous en avez discuté au préalable avec votre médecin. Votre médecin prendra en considération le bénéfice du traitement par Ocrevus par rapport au risque pour votre bébé.
Adressez-vous à votre médecin avant de faire vacciner votre bébé.
Contraception pour les femmes
Les femmes en âge de procréer doivent utiliser une contraception :
pendant le traitement par Ocrevus et
durant les 4 mois qui suivent votre dernière perfusion d’Ocrevus.
Allaitement
Ocrevus peut être administré pendant l’allaitement. Demandez à votre médecin quelle est la meilleure façon de nourrir votre bébé si vous recevez Ocrevus.
Conduite de véhicules et utilisation de machines
On ne sait pas si Ocrevus peut affecter votre aptitude à conduire ou à utiliser des outils ou des machines. Votre médecin vous dira si votre SEP peut affecter votre aptitude à conduire ou à utiliser des outils ou des machines en toute sécurité.
Ocrevus contient du sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER OCREVUS
Ocrevus vous sera administré par un médecin ou un(e) infirmier/ère qui est expérimenté dans l’utilisation de ce traitement. Vous serez étroitement surveillé pendant l’administration du médicament. Vous pourriez en effet présenter des effets indésirables. Ocrevus vous sera toujours administré en perfusion intraveineuse.
Médicaments reçus avant Ocrevus
Avant l’administration d’Ocrevus, vous recevrez d’autres médicaments afin de prévenir ou de réduire le nombre d’éventuels effets indésirables tels que des réactions associées à la perfusion (voir rubriques 2 et 4 pour les informations relatives aux réactions associées à la perfusion).
Vous recevrez un corticoïde et un antihistaminique avant chaque perfusion et vous recevrez peut-être aussi des médicaments pour réduire la fièvre.
Quelle quantité d’Ocrevus vous allez recevoir et à quelle fréquence
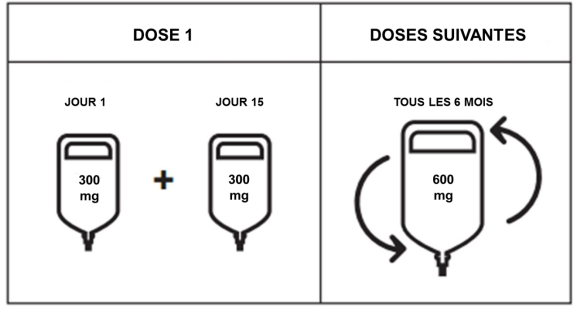
Vous recevrez une dose totale de 600 mg d’Ocrevus tous les 6 mois.
La première dose de 600 mg d’Ocrevus sera administrée en 2 perfusions séparées (de 300 mg chacune) à 2 semaines d’intervalle. Chaque perfusion durera environ 2 heures et 30 minutes.
Les doses suivantes de 600 mg d’Ocrevus seront administrées en une perfusion unique. En fonction de la vitesse de la perfusion suivante, chaque perfusion durera soit environ 3 heures et 30 minutes, soit 2 heures.
Comment utiliser Ocrevus
Ocrevus vous sera administré par un médecin ou un(e) infirmier/ère. Il sera administré en perfusion dans une veine (perfusion intraveineuse ou perfusion « IV »).
Vous serez étroitement surveillé pendant la perfusion d’Ocrevus et pendant au moins 1 heure après l’administration de la perfusion. Vous pourriez en effet développer des effets indésirables tels que des réactions associées à la perfusion. La perfusion peut être ralentie, interrompue temporairement ou arrêtée définitivement si vous développez une réaction associée à la perfusion, en fonction de sa gravité (voir rubriques 2 et 4 pour les informations relatives aux réactions associées à la perfusion).
Si vous oubliez une perfusion d’Ocrevus
Si vous oubliez une perfusion d’Ocrevus, adressez-vous à votre médecin pour recevoir cette perfusion le plus rapidement possible. N’attendez pas jusqu’à votre prochaine perfusion planifiée.
Il est important que vous receviez chaque perfusion au moment prévu pour obtenir le bénéfice complet d’Ocrevus.
Si vous arrêtez le traitement par Ocrevus
Il est important de poursuivre votre traitement aussi longtemps que vous-même et votre médecin estimerez que ce traitement vous aide.
Certains effets indésirables peuvent être liés à un taux de lymphocytes B bas. Après l’arrêt du traitement par Ocrevus, vous pourriez toujours présenter des effets indésirables jusqu’à ce que vos lymphocytes B reviennent à un taux normal. Votre taux de lymphocytes B circulant augmentera progressivement pour revenir à des taux normaux. Cela peut prendre 6 mois à 2 ans et demi, voir même plusieurs années dans de rares cas.
Avant de débuter tout autre médicament, informez votre médecin du moment auquel vous avez reçu votre dernière perfusion d’Ocrevus.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin.
4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets indésirables suivants ont été rapportés avec Ocrevus :
Effets indésirables graves :
Réactions associées à la perfusion
Les réactions associées à la perfusion sont l’effet indésirable le plus fréquent du traitement par Ocrevus (très fréquent : peut affecter plus d’1 personne sur 10). Dans la majorité des cas, ces réactions sont légères mais certaines réactions graves peuvent se produire.
Informez immédiatement votre médecin ou votre infirmier/ère si vous présentez tout signe ou symptôme d’une réaction associée à la perfusion au cours de la perfusion ou jusqu’à 24 heures après la perfusion.
Les symptômes peuvent inclure, mais ne sont pas limités à :
- démangeaisons cutanées
- éruption cutanée
- urticaire
- rougeur de la peau
- irritation ou douleur de la gorge
- essoufflement
- gonflement de la gorge
- bouffées vasomotrices
- hypotension
- fièvre
- sensation de fatigue
- céphalées
- étourdissements
- se sentir mal (nausées)
- battements cardiaques rapides.
Si vous développez une réaction associée à la perfusion, vous recevrez des médicaments pour traiter cette réaction et la perfusion devra peut-être être ralentie ou arrêtée. Quand la réaction sera terminée, la perfusion pourra être poursuivie. Si la réaction associée à la perfusion engage le pronostic vital, votre médecin arrêtera définitivement votre traitement par Ocrevus.
Infections
Vous pourriez contracter plus facilement des infections avec Ocrevus. Les infections suivantes ont été observées chez les patients traités par Ocrevus dans la SEP :
- Très fréquent (peut affecter plus d’1 personne sur 10)
- maux de gorge et écoulement nasal (infection des voies respiratoires supérieures)
- grippe
- Fréquent (peut affecter jusqu’à 1 personne sur 10)
- infection des sinus
- bronchite (inflammation de l’arbre bronchique)
- infection herpétique (bouton de fièvre ou zona)
- infection de l’estomac et de l’intestin (gastroentérite)
- infection des voies respiratoires
- infection virale
- infection de la peau (cellulite)
Certaines de ces infections peuvent être graves.
• Informez immédiatement votre médecin ou votre infirmier/ère si vous présentez l’un de ces signes d’infection:
- fièvre ou frissons
- toux qui ne disparaît pas
- herpès (comme un bouton de fièvre, un zona ou un herpès génital)
Autres effets indésirables :
Très fréquent (peut affecter plus d’1 personne sur 10)
diminution de protéines spécifiques dans le sang (immunoglobulines) qui contribuent à protéger contre les infections
Fréquent (peut affecter jusqu’à 1 personne sur 10)
écoulement oculaire avec démangeaisons, rougeur et gonflement (conjonctivite)
toux
accumulation de mucus épais dans le nez, la gorge ou les bronches
faible quantité d’un type de globule blanc (neutropénie).
Fréquence indéterminée (on ne sait pas à quelle fréquence ces effets indésirables surviennent)
diminution des globules blancs pouvant arriver tardivement
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration (voir ci-dessous). En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Pour la France
Agence nationale de sécurité du médicament et des produits de santé (ANSM)
et réseau des Centres Régionaux de Pharmacovigilance
Site internet: https://signalement.social-sante.gouv.fr/
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
5. COMMENT CONSERVER OCREVUS
Ocrevus sera conservé par des professionnels de santé à l’hôpital ou la clinique, dans les conditions suivantes :
Ce médicament doit être tenu hors de la vue et de la portée des enfants.
Ce médicament ne doit pas être utilisé après la date de péremption indiquée sur la boîte et sur l’étiquette du flacon après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Ce médicament doit être conservé au réfrigérateur (entre 2 oC et 8 oC). Il ne doit pas être congelé. Les flacons doivent être conservés dans l’emballage extérieur afin de les protéger de la lumière.
Ocrevus doit être dilué avant de vous être administré. La dilution sera effectuée par un professionnel de santé. Il est recommandé d’utiliser le produit immédiatement après dilution. Si la solution n’est pas utilisée immédiatement, la durée et les conditions de conservation avant l’utilisation relèvent de la responsabilité du professionnel de santé et ne doivent normalement pas dépasser 24 heures à une température comprise entre 2 °C et 8 °C puis 8 heures à température ambiante.
Ne jetez aucun médicament au tout-à-l’égout. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient Ocrevus
La substance active est l’ocrelizumab. Chaque flacon contient 300 mg d’ocrelizumab dans 10 mL à une concentration de 30 mg/mL.
Les autres composants sont l’acétate de sodium trihydraté (voir Rubrique 2 « Ocrevus contient du sodium »), l’acide acétique glacial, le tréhalose dihydraté, le polysorbate 20 et l’eau pour préparations injectables.
Qu’est-ce qu’Ocrevus et contenu de l’emballage extérieur
Ocrevus est une solution limpide à légèrement opalescente et incolore à marron pâle.
Elle se présente en solution à diluer pour perfusion.
Ce médicament se présente en boîtes contenant 1 ou 2 flacons (flacons de 10 mL de solution à diluer). Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’Autorisation de mise sur le marché
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
Fabricant
Roche Pharma AG
Emil-Barell-Strasse 1
D-79639 Grenzach-Wyhlen
Allemagne
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien | Luxembourg/Luxemburg | |
France |
| |
|
| |
La dernière date à laquelle cette notice a été révisée est février 2025
Autres sources d’informations
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
Les informations suivantes sont exclusivement destinées aux professionnels de santé :
Lire le RCP pour plus d’informations.
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré devraient être clairement enregistrés.
Posologie
Dose initiale
La dose initiale de 600 mg est administrée en deux perfusions intraveineuses séparées ; une première perfusion de 300 mg, suivie 2 semaines plus tard d’une seconde perfusion de 300 mg.
Doses suivantes
Les doses suivantes d’ocrelizumab sont administrées en perfusion intraveineuse unique de 600 mg tous les 6 mois (voir Tableau 1). La première des doses suivantes de 600 mg doit être administrée 6 mois après la première perfusion de la dose initiale. Un intervalle minimal de 5 mois doit être maintenu entre chaque dose d’ocrelizumab.
Figure 1 : Dose et schéma d’administration d’Ocrevus

Prise en charge des RAP avant la perfusion
Le traitement doit être instauré et surveillé par un professionnel de santé expérimenté ayant accès au matériel médical nécessaire à la prise en charge des effets indésirables sévères tels que les réactions associées à la perfusion (RAP) graves, les réactions d’hypersensibilité et/ou les réactions anaphylactiques.
Prémédication pour les réactions associées à la perfusion
Les deux prémédications suivantes doivent être administrées avant chaque perfusion d’ocrelizumab afin de réduire la fréquence et la sévérité des RAP :
- 100 mg de méthylprednisolone par voie intraveineuse (ou un équivalent) environ 30 minutes avant chaque perfusion ;
- antihistaminique environ 30 à 60 minutes avant chaque perfusion ;
De plus, une prémédication par un antipyrétique (par exemple, paracétamol) peut également être envisagée environ 30 à 60 minutes avant chaque perfusion.
Une hypotension, en tant que symptôme de RAP, peut survenir au cours des perfusions. Par conséquent, une interruption des traitements antihypertenseurs doit donc être envisagée 12 heures avant et pendant chaque perfusion d’Ocrevus. Les patients avec un antécédent d’insuffisance cardiaque congestive (classe III & IV de la classification New York Heart Association) n’ont pas été étudiés.
Instructions de dilution
Le produit doit être préparé par un professionnel de santé utilisant une technique aseptique. Ne pas agiter le flacon. Une aiguille et une seringue stériles doivent être utilisées pour préparer la solution diluée pour perfusion.
Le produit est à usage unique.
La solution peut contenir de fines particules translucides et/ou réfléchissantes associées à une plus forte opalescence. Ne pas utiliser la solution en cas de décoloration ou si la solution contient des particules étrangères.
Le médicament doit être dilué avant l’administration. Les solutions pour administration intraveineuse sont préparées par dilution du produit dans une poche de perfusion contenant du chlorure de sodium isotonique 9 mg/mL (0,9 %) solution pour perfusion (300 mg/250 mL ou 600 mg/500 mL), jusqu’à une concentration finale d’ocrelizumab d’environ 1,2 mg/mL.
La solution diluée pour perfusion doit être administrée à l’aide d’une tubulure de perfusion avec un filtre intégré de 0,2 ou 0,22 micron.
Avant le début de la perfusion intraveineuse, le contenu de la poche de perfusion doit être à température ambiante afin d’éviter une réaction associée à la perfusion due à l’administration de la solution à basse température.
Mode d’administration
Après dilution, le traitement est administré par perfusion intraveineuse réservée à ce seul produit.
Les perfusions ne doivent pas être administrées en injection rapide ou en bolus.
Tableau 1 : Dose et schéma d’administration
| Quantité d’ocrelizumab à administrer | Instruction relative à la perfusion | |
Dose initiale | Perfusion 1 | 300 mg dans 250 mL | Débuter la perfusion à une vitesse de 30 mL/heure pendant 30 minutes |
Perfusion 2 | 300 mg dans 250 mL | ||
Doses suivantes | Option 1 | 600 mg dans 500 mL | Débuter la perfusion à une vitesse de 40 mL/heure pendant 30 minutes |
| OU | ||
| Option 2 | 600 mg dans 500 mL | Débuter la perfusion à une vitesse de 100 mL/heure pendant les 15 premières minutes |
Prise en charge des RAP pendant et après la perfusion
Les patients doivent être surveillés pendant la perfusion et pendant au moins 1 heure après la fin de la perfusion.
Pendant la perfusion
Ajustements de la perfusion en cas de RAP
En cas de RAP au cours d’une perfusion, voir les ajustements ci-dessous.
RAP engageant le pronostic vital
En cas de signes d’une RAP engageant le pronostic vital ou d’une RAP invalidante au cours d’une perfusion, telle qu’une réaction d’hypersensibilité aiguë ou un syndrome de détresse respiratoire aiguë, la perfusion doit être immédiatement arrêtée et le patient doit recevoir un traitement approprié. La perfusion doit être définitivement arrêtée chez ces patients (voir rubrique 4.3).
RAP sévères
Si un patient présente une RAP sévère (telle que dyspnée) ou un ensemble de symptômes comprenant bouffées vasomotrices, fièvre et douleur pharyngée, la perfusion doit être immédiatement interrompue et le patient doit recevoir un traitement symptomatique. La perfusion ne sera reprise qu’après la résolution de tous les symptômes. La vitesse de perfusion initiale à la reprise du traitement doit être réduite de moitié par rapport à la vitesse de perfusion au moment de l’apparition de la réaction. Aucun ajustement de la perfusion n’est nécessaire pour les nouvelles perfusions suivantes sauf si le patient présente une RAP.
RAP légères à modérées
Si un patient présente une RAP légère à modérée (par exemple céphalées), la vitesse de perfusion doit être réduite de moitié par rapport à la vitesse de perfusion lors de l’apparition de l’événement. Cette vitesse de perfusion réduite doit être maintenue pendant au moins 30 minutes. Si elle est tolérée, la vitesse de perfusion peut alors être augmentée conformément à la vitesse de perfusion initiale du patient. Aucun ajustement de la perfusion n’est nécessaire pour les nouvelles perfusions suivantes sauf si le patient présente une RAP.
En cas de symptômes pulmonaires sévères, tels que bronchospasme ou exacerbation de l’asthme, la perfusion doit être immédiatement et définitivement arrêtée. Après l’administration d’un traitement symptomatique, surveiller le patient jusqu’à la résolution des symptômes pulmonaires car l’amélioration initiale des symptômes cliniques peut être suivie d’une détérioration.
L’hypersensibilité peut être cliniquement indiscernable d’une RAP sur le plan symptomatique. En cas de suspicion d’une réaction d’hypersensibilité au cours de la perfusion, la perfusion doit être arrêtée immédiatement et définitivement.
Après la perfusion
Les patients doivent rester en observation pendant au moins une heure après la fin de la perfusion afin de détecter tout symptôme de RAP.
Les médecins doivent prévenir leurs patients que des RAP peuvent survenir dans les 24 heures suivant la perfusion.
Durée de conservation
Flacon fermé
2 ans
Solution diluée pour perfusion intraveineuse
La stabilité chimique et physique de la solution diluée est de 24 heures à une température comprise entre 2 °C et 8 °C puis de 8 heures à température ambiante.
D’un point de vue microbiologique, la solution préparée doit être utilisée immédiatement. Si la solution n’est pas utilisée immédiatement, la durée et les conditions de conservation avant l’utilisation relèvent de la responsabilité de l’utilisateur et ne doivent pas dépasser 24 heures à une température comprise entre 2 °C et 8 °C puis 8 heures à température ambiante, sauf si la dilution est effectuée dans des conditions aseptiques contrôlées et validées.
Si une perfusion intraveineuse n’est pas terminée à la fin de la journée, la solution restante doit être jetée.
PRIX
| Code CNK | Emballage | Prix | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|
| 3519014 | OCREVUS 300MG SOL POUR PERF 30MG/ML FL INJ 1X10ML | - | Oui | - | - |